Celule electrochimice
Partajeaza in Google Classroom
Teorie: Teorie - Celule electrochimice Descarcă PDF
Celule electrochimice
În anumite sisteme electrochimice, transferul de electroni poate fi dirijat în aşa fel încât să aibă loc sub forma unui curent electric care traversează un anume material. Astfel, se obţine electricitatea.
Substanţele conductoare sau conductorii sunt substanţe care permit trecerea curentului electric. Conductorii electrici sunt de două feluri: conductori metalici şi electroliţi.
Conductorii metalici sunt substanţele care conduc curentul electric cu ajutorul electronilor, deci în acest caz, electronii sunt purtătorii de sarcină.
Electroliţii sunt substanţele care conduc curentul electric cu ajutorul ionilor, deci în acest caz, ionii sunt purtătorii de sarcină. Acizii, bazele şi sărurile sunt electroliţi numai în soluţie sau în topitură. Conductibilitatea lor electrică se explică prin mobilitatea ionilor care se formează în urma reacţiilor de ionizare.
Neelectroliţii sau izolatorii electrici sunt substanţele care nu conduc curentul electric în nicio stare de agregare. Exemple de astfel de substanţe sunt sulful, sau plasticul.
Celula electrochimică este definită ca un sistem format din doi electrozi, o punte de sare şi un conductor metalic exterior. Acest sistem transformă energia chimică în energie electrică. Celulele electrochimice se mai numesc şi elemente galvanice sau elemente voltaice.
Electrodul este, de fapt, un solid aflat într-o soluţie ce conţine o specie activă redox (ioni sau molecule care pot lua parte la reacţii redox). La interfaţa dintre solid şi soluţie se produc reacţiile de oxidare sau de reducere, adică are loc transferul de electroni. Un electrod este, de obicei, un ansamblu format dintr-o plăcuţă metalică şi o soluţie de electrolit. Acest ansamblu se mai numeşte şi semicelulă galvanică.
Anodul este electrodul la care are loc reacţia de oxidare şi se simbolizează prin semnul minus, (-).
Catodul este electrodul la care are loc reacţia de reducere şi se simbolizează prin semnul plus, (+).
Puntea de sare este, de obicei, un tub gol de sticlă care conţine o soluţie concentrată de sare (KCl, NaNO3, NH4Cl). Această soluţie conţine ioni cu mobilitate ridicată. Deci puntea de sare oferă ionilor o cale de a circula dintr-un vas în altul pentru a menţine cele două soluţii neutre şi pentru a închide circuitul electric.
Conductorul metalic din componenţa unei celule electrochimice este firul care leagă cei doi electrozi şi permite transportul electronilor de la anod la catod. În circuitul exterior poate fi legat şi un voltmetru care indică voltajul curentului de electroni ce va trece prin fir. În momentul în care puntea de sare este plasată la locul ei, făcând legătura între cei doi electrozi, electronii vor începe să circule prin conductorul metalic.
Celula Daniell sau pila Daniell este primul dispozitiv capabil să conducă un curent electric constant, fiind deci prima sursă practică de electricitate.
Reacţia care are loc, per ansamblu, în cadrul unei celule Daniell:
Zn + CuSO4 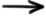 ZnSO4 + Cu
ZnSO4 + Cu
Aceeaşi reacţie ar avea loc la simpla introducere a zincului în sulfat de cupru. Însă, deoarece în cazul celulei Daniell procesele de oxidare a Zn0 la Zn2+ şi de reducere a Cu2+ la Cu0 au loc în spaţii separate, reacţia generază curent electric.
Procesele care au loc la anodul şi la catodul celulei Daniell:
(-) anod: Zn0 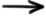 Zn2+ + 2e- (oxidare)
Zn2+ + 2e- (oxidare)
(+) catod: Cu2+ + 2e- 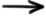 Cu0 (reducere)
Cu0 (reducere)
Pila electrică este formată din mai multe celule electrochimice. Dispozitivul lui Daniell avea nevoie de mai multe celule pentru a genera suficient curent electric, de aceea, acest dispozitiv se întâlneşte mai frecvent sub denumirea de Pila Daniell.
Celulele electrochimice moderne sunt cunoscute şi sub denumirea de pile uscate sau baterii. În mod curent, se utilizează următoarele tipuri de celule electrochimice moderne:
1. Celulele primare: acestea sunt celule de unică folosinţă care nu se mai pot încărca. De exemplu, bateriile pentru lanternă sau pentru ceas.
2. Celulele secundare: acestea sunt celulele care se pot reîncărca, sau acumulatorii. De exemplu, bateria unui laptop sau a unui telefon. Acumulatorul cu Plumb este prima celulă galvanică reîncărcabilă; se utilizează şi astăzi la automobile.
3. Pilele de combustie.






