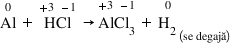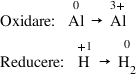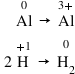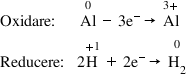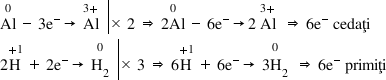Coeficienţii stoechiometrici în ecuaţiile reacţiilor redox
Partajeaza in Google Classroom

Transcript
uite si asta vom vedea cum putem
Stabiliți coeficienții stoechiometrici
în ecuațiile reacțiilor redox analiza
proceselor de oxidare și de reducere
ne e foarte utilă la stabilirea
coeficienților respectiv această
metodă care se numește metoda redox
e foarte rapidă și se bazează pe
faptul că numărul electronilor
primiți trebuie să fie întotdeauna
cu numărul electronilor cedați
Ca exemplu vom lua chiar reacția
de mai devreme cea dintre aluminiu
și acid clorhidric mai întâi scriem
ecuația reacției Fără coeficient
Pentru a stabili cu o eficiență
stoechiometrici va trebui să parcurgem
următoarele etape Pentru a stabili
cu o fi ciente stoechiometrici
va trebui să parcurgem următoarele
etape stabilirea ale tuturor atomilor
identificând astfel atomi care
își modifică numărul de oxidare
vedem hidrogenul și aluminiu și
au schimbat numărul de oxidare
aluminiul sau ce Da iar hidrogenul
se reduc apoi vom scrie ecuația
celor două Sami reacții aluminiul
care cedează trei electroni și
se transformă în ionul aluminiu
plus 3 acesta fiind procesul de
oxidare și apoi eul de hidrogeni
plus care primește un electron
acesta fiind procesul de reducere
mai departe observăm că trebuie
să egalăm numărul de atomi din
fiecare Sami reacție în cazul aluminiului
nu se schimbă nimic în Sălaj hidrogeno
observăm că pentru a forma o moleculă
de hidrogen e nevoie de doi atomi
de hidrogen Acum putem stabili
numărul de electroni primit sau
ce dați în fiecare Sami reacție
în Sami reacția de oxidare aluminiul
cedează trei electroni Transformând
acest fel în ionul de aluminiu
plus 3 iar în semi reacția de reducere
doi Ioni de hidrogen plus primesc
câte un electron Deci în total
doi electroni formând astfel o
moleculă de hidrogen în următoarea
etapă trebuie să echilibrăm cele
două semne de cont de faptul că
numărul electronilor cedați trebuie
să fie egal cu numărul electronilor
primit Deci găsim cel mai mic multiplu
comun al numerelor de electroni
primit și cedați în acest caz acesta
este 6 dacă nu mai ține nuntă de
la matematică vă reamintesc cel
mai mic multiplu comun se calculează
mai întâi se descompun numerele
în produs de factori primi apoi
să iau factorii comuni și ne comuni
o singură dată la puterea cea mai
mare și se înmulțesc În cazul nostru
este foarte simplu pentru că avem
deja două numere prime din mulțimile
iar cel mai mic multiplu comun
va fi și în cazul Sami reacției
de oxidare împărțim 6 la 3:00 adică
la numărul de electroni cedat obținem
2 și înmulțim Sami reacția cu 2
obținând astfel aluminiu și coeficientul
stoichiometric al clorului de el
în cazul Sami reacției de reducere
aparțin 6 la 2 adică la numărul
electronilor primit obținem valoarea
3 și înmulțim Sami reacției cu
trei astfel obținem coeficientul
stoechiometric al acidului clorhidric
și coeficientul stoechiometrica
al hidrogeni Așadar avem un total
de 6 electronice dat și 6 electroni
primi după aceasta introducem acești
coeficienți eu în ecuația globală
a reacției Avem doi la aluminiu
șase la acidul clorhidric 2 la
clorura de aluminiu și trei la
hidrogen de parte ar trebui Stabiliți
și coeficienții celorlalte specii
care iau parte la reacție în funcție
de coeficienții stabilite anterior
însă în cazul acestei reacții nu
avem alte specii așa că au voulu
acum un alt exemplu o reacție redox
la care participă mai multe specifici
este vorba de reacția de oxidare
a acidului clorhidric la clor cu
permanganat de potasiu fie întâi
stabilim numerele de oxidare pentru
fiecare atom de observăm că atomi
care își modifică numărul de oxidare
sub manganul și clorul apoi scriem
ecuațiile celor două Sami reacții
de reducere ionul de mangan plus
7 se în reducerea ionul de mangan
plus 2 și semi reacția de oxidare
ionul de clor minus cedează la
clor acum vă mai gala numărul de
atomi din fiecare semi reacție
în cazul clorului este nevoie de
doi atomi pentru a forma aa molecula
de clor mai departe stabilind numărul
de electroni cedați sau primit
ionul mengen plus șapte primește
cinci electroni și se reduce la
ionul mengen plus doi doi Ion de
clor minus cedează fiecare câte
un electron Deci în total ce formează
molecula de clor cel mai mic multiplu
comun al numerelor de electronice
dați în fiecare Samir este 2 ori
5 10 împărțiri 10 la 5 la numărul
electronilor acceptați de mangal
și obținem 2 înmulțit reacția procesului
de reducere cu 2 astfel am obținut
coeficienții stoechiometrici ai
permanganatului de potasiu și ai
clorurii de mangan continuare împărțim
10:00 la 2:00 adică la numărul
electronilor cedați de iahnie de
clor și obținem 5 10 mulțimi Sami
reacții a procesului de oxidare
cu cinci și astfel am obținut și
coeficienții stoechiometrice ai
acidului clorhidric și ai clorului
și avem un total de 10 electroni
primiți și 10 electronice dați
introducem coeficienții astfel
obținute aglo valoare activ Deci
coeficientul 2 la permanganatul
de potasiu și la clorura de mangan
la clor avem coeficientul 5 și
știm că la acidul clorhidric ar
trebui să avem coeficientul 10
însă trebuie să fim atenți mai
sunt și alți produs de reacție
care conține doar așa că vom calcula
coeficienții celorlalte specii
chimice participante la reacție
redox ținând cont de legea conservării
masei în cazul nostru legea conservării
masei se referă la faptul că numărul
de atomi de orice tip care intră
în reacție sub formă de reactant
este întotdeauna egal cu un numărul
de atomi ca legislație sub formă
de produs Deci avem aici eu doi
atomi de mangan care intră în reacție
și la produși tot băiatul doi atomi
de potasiu înseamnă că și aici
trebuie să fie tot doi atomi de
potasiu 2 ori 4 este 8 Deci avem
8 atomi de oxigen ne uităm unde
e mai apare oxigenul apare în molecula
de apă Deci coeficientul molecule
de apă va fi o molecula de apă
conțin însăși Great un de hidrogen
în total 2 ori o avem 16 atomi
de hidrogen în această parte a
reacției Deci în cazurile actanți
lor va trebui să avem tot 16 atomi
de hidrogen să verificăm dacă numărul
atomilor de clor de la reactanți
corespunde cu numărul atomilor
de flori de la produs în partea
reactanților avem 16 iar în partea
produșilor avem 254 Deci 14 și
cu încă doi de aici avem așadar
am stabilit corect coeficienții
stoechiometrici ai acestei ecuații
metoda reginei ajută foarte mult
de exemplu un laborator cu un trebuie
să calculăm cantitățile de reactanți
eu necesare pentru o anumită reacție
viitoare vom vedea mai de aproape
care e principiul de funcționare
din spatele bateriilor care ne
au devenit indispensabile adică
vom vorbi despre celule electrochimice

 cC + dD
cC + dD