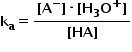Acid tare:
- atomul de hidrogen se desprinde foarte ușor de nemetal;
- legătura covalentă este polară și slabă;
- baza conjugată A- este slabă (mai slabă decât apa);
- echilibrul reacției de disociere a acidului în apă este deplasat complet spre dreapta.
Un acid tare duce la formarea unei baze conjugate slabe: acid tare/bază conjugată slabă.
Reacția de disociere a unui acid tare – disociere completă, echilibrul deplasat total spre dreapta:
HA(aq) + H2O(l) → A-(aq) + H3O+(aq)
Acid slab:
- atomul de hidrogen se desprinde greu de nemetal;
- baza conjugată A- este mai tare decât apa;
- echilibrul reacției de disociere a acidului în apă este deplasat foare mult spre stânga: la echilibru, majoritatea moleculelor de acid se găsesc sub formă nedisociată.
Un acid slab duce la formarea unei baze conjugate tari: acid slab/bază conjugată tare.
Reacția de disociere a unui acid slab în apă – grad de disociere foarte mic, echilibrul este deplasat foarte mult spre stânga:
HA(aq) + H2O(l)  A-(aq) + H3O+(aq)
A-(aq) + H3O+(aq)
Constanta de aciditate, ka care caracterizează echilibrul de mai sus are următoarea expresie:
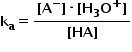
În cazul acizilor slabi, ka are valori foarte mici. De aceea, de foarte multe ori, valoarea constantei de aciditate se exprimă prin exponentul de aciditate, pka, care este definit prin relația: pka = -lg ka
Tabelul de mai jos prezintă mai multe căi de a descrie tăria acizilor:
|
Proprietate
|
Acid slab
|
Acid tare
|
|
Valoarea ka
|
foarte mică
|
foarte mare
|
|
Valoarea pka
|
pozitivă
|
negativă
|
|
Echilibrul reacției de ionizare
|
deplasat foarte mult spre stânga
|
deplasat foarte mult spre dreapta (se consideră complet deplasat spre dreapta)
|
|
Tăria bazei conjugate A- comparativ cu tăria apei
|
mult mai tare decât apa
|
mult mai slabă decât apa
|
Acizi tari: HCl, HBr, HI, HNO3, H2SO4, HClO4.
Acizi slabi (există mult mai mulți acizi slabi decât acizi tari): H2CO4, CH3 – COOH, HF, H3PO4, etc.

 A-(aq) + H3O+(aq)
A-(aq) + H3O+(aq)