Tăria bazelor. Constanta de bazicitate și exponentul de bazicitate.
Tag-uri
Partajeaza in Google Classroom

Transcript
după ce am vorbit atâta despre
acizi Alfa Ar fi cazul să ne reamintim
și cum stă treaba cu bazele conform
teoriei protolitice broaște de
Lauri o bază este orice specifică
care poate accepta un Proton Deci
o bază este un acceptor de protoni
bazele trebuie să aibă cel puțin
o pereche de electroni neparticipanți
de legătură pentru a putea trage
plutonul unei alte molecule protonul
are sarcină pozitivă Așadar ilogică
va fi atras de o sarcină negativă
oferită de electroni neparticipanți
la legătură și la fel ca în cazul
acizilor și bazele se clasifică
în funcție de Tăria lor Așadar
avem baze tari și baze basmele
tari sunt cele care acceptă protonii
foarte foarte ușor hidroxizii metalelor
alcaline și oxizii unor metale
alcaline o pământul ei sunt toate
baze tari aceste substanțe disociază
completă soluții apoase să luăm
exemplul unei soluții de oxid de
potasiu 0 molar oxid de potasiu
în apă și vedem Că a disociat complet
în Ioni săi și Ce înseamnă că Adi
social sau că ai ionizat complet
înseamnă că această soluție conține
de fapt 0 molar Ion de potasiu Deci
concentrația molară ionilor de
potasiu este 0 molar iar concentrația
ionilor hidroxil este tot 0 Milan
Haideți analizăm acum Ce se întâmplă
la dizolvarea bazelor slavei în
apă avem o vază oarecare b care
atunci când se dizolvă în apă acceptă
un Proton de la o moleculă de apă
observa că de data aceasta Apa
este un acid și donând un Proton
se transformă în ionul hidroxi
expresia constantei de echilibru
a dizolvării unei baze slabe în
apă este aceasta și exact ca în
cazul acelor slabi și în cazul
pătrat în concentrația apei la
echilibru ca pe o constantă Să
ne amintim că motivul pentru care
facem acest lucru este că bazele
slab acceptă foarte greu protoni
Așadar la echilibru foarte puține
molecule de bază se vor transforma
în Ion în soluție apoasă Deci aici
putem să reducem acesteia concentrația
apei și vom obține Constanța de
bazicitate pe care o notăm cu cob
și care se exprimă prin această
relație din relația prin care definim
postata de bazicitate pentru dizolvarea
unei baze oarecare în apă Constanța
de bazicitate este o măsură care
ne ajută să determina bazelor slate
să vedem care dintre mai multe
Ba Deci se mai tare valoarea acestei
constante de bazicitate se exprimă
și folosind cuvântul de bazicitate
pe care îl notăm cu pe cap de știi
deja că peste un operator matematică
are este egal cu minus logaritm
zecimal așa dar pe cap de este
egal cu minus logaritm zecimal
din cub adică din Constanta de
bazicitate și cu cât valoarea constantei
de bazicitate este mai mare exponentul
de bazicitate este mic iar baza
este mai tare Haide să vedem acum
și câteva exemple limba de slaba
foarte mulți compuși care conțin
un atom de azot cu electroni neparticipanți
a legătură sunt baze slabe Spre
exemplu amoniacul Otoman de azi
o tare o pereche de electroni neparticipanți
în legătură dar și aminele cu aceste
formule generale sunt baze slabe
în fiecare caz atomul de azot are
electroni neparticipanți la legătură
cu a r sunt Notați radicalii organici
Spre exemplu sunt baze slabe acesteia
mine metilamina dietilamina sau
trimetilamina dacă ați fost atenți
lecția aceasta căci lecția trecută
când am vorbit despre acizi Ați
observat cu siguranță că apa este
un dublu agent reacționează cu
un acid apa joacă rol de bază iar
creațiunea ză cu o bază Apa este
un acid Haideți pe luăm exemplul
dizolvării acidului acetic în apă
când acidul acetic se dizolvă în
apă Union de hidrogen este transferat
de la acidul acetic la omule cură
de apă unde se va atașa de una
dintre cele două perechi de electroni
neparticipanți de pe atomul de
oxigen molecular de apă care a
captat protonul acidului acetic
se transformă în ionul hidroniu
putem zice că protonul plictisit
de companie a electronilor care
leagă de molecula de acid se plimbă
să mai afle vești și de la electroni
din moleculele de apă Oricum În
exemplul de față foarte puțin protoni
găsesc agreabilă compania apei
se vor întoarce rapid să reformeze
Latex mintim din lecția trecută
că acest lucru înseamnă că e anul
acesta Care este baza conjugată
a acidului acetic este o bază mult
mai tare decât apa de să notăm
pe reacții că apa aici joacă rolul
de bază iar acidul conjugat este
Ionuț Deci acidul a donat un Proton
iar apa bază la acceptat protonii
se plimbă la fel de mult în soluție
și în cazul în care avem o bază
care se dizolvă în apă Spre exemplu
amoniacul în acest Exemplu un Proton
de la o molecule de apă de perechea
de electroni neparticipanți atomului
de azot din molecula de amoniac
astfel molecula de amoniac împreună
cu protonul primit de la apă amoniu
rămasă fără un Proton apa devine
Ion hidroxil Așadar în acest caz
apa joacă rolul de acid iar baza
conjugată este Ionuț draxin amoniacul
este o bază slabă iar acidul tău
conjugat este ionul amoniu reamintim
din capitolele că acestă comportament
al apei presupune că ea este o
substanță amfotere și vom face
aici o paranteză mai definim o
dată ce înseamnă de fapt substanță
amfotere Deci o substanță amfotere
numită și substanță am fi pratică
sau avion este o substanță care
joacă rolul de acid în reacția
cu bazele și joacă rol de bază
în reacția cu acizii Apa este un
exemplu de substanță amfotere însă
există multe astfel de substanțe
de exemplu Ion sulfură acidă acest
Ion are un atom de hidrogen legat
cu Valer polar de un atom de sulf
se poate ceda în reacția cu o bază
Deci în această reacție ai anul
fluturasi de joacă rolul de acid
acest ionare și o pereche de elevi
participanți la legătură la atomul
de sulf și astfel eu nu poate accepta
un pluton între o reacție cu un
acid din această reacție racii
de joacă rolul de baza Acesta este
un alt exemplu de substanță Apa
este o substanță amfotere mai specială
rolul pe care îl joacă apa în echilibre
acidobazice este atât de important
încât echilibrul de autori ionizare
al apei cu Ioni hidroniu și hidroxil
este folosit ca asta în Dar pentru
Definirea citită ții sau bazicitatii
soluțiilor apoase Haideți să vedem
de ce avem această reacție Generală
de ionizare a unei baze este de
protoni în acest caz de ce este
un acid iar baza a conjugată este
ionul hidroxil b este baza si care
acceptând protonul se transformă
în acidul conjugat va pus acum
am văzut mai devreme Constanța
de bazicitate care descrie această
reacție are această expresie reacția
sare a acidului conjugat al acestei
baze de ce acidul lui b h plus
este următoarea aici molecula de
apă joacă rolul de bază iar acidul
Care ionizează este acesta ridică
acidul conjugat al bazei de această
reacție de ionizare este caracterizată
prin constantă de aciditate ca
a care are următoarea expresie
suma acestor două reacții nu este
alta decât reacția de auto ionizare
a apei iar echilibrul acestei reacții
de ionizare este caracterizat prin
Constanța de autorizare a apei
cunoscută sub numele de produsul
ionic al apei notat cu kW și care
este egal cu produsul dintre concentrațiile
molare ale ionilor hidroniu și
roxel la 25 de grade Celsius produsul
ionic al apei este egal cu 10 la
minus 14 m la a doua supra litrul
a doua Haideți să notăm aici că
acesta este produsul ionic al apei
în multe din constantele de bazicitate
și aciditate ale cuplului baza
acest conjugat de DH plus Deci
Înmulțind ca tu ca a obține exact
produsul ionic al apei Aceasta
este o relație între constantele
de disociere ale cuplurilor acidobazice
conjugate Care este extrem de utilă
pentru efectuarea problemelor de
calcul de obicei Chiar și în cazul
bazelor e mai ușor să găsim tabela
valorile constantelor de aciditate
decât ale constantelor de bazicitate
și vedem că din această relație
este extrem de ușor să calculăm
Constanta de bazicitate trebuie
numai să reținem că această relație
este valabilă numai la o temperatură
de 25 de grade o altă consecință
a acestei relații este faptul că
pe ca a luat pe ca b este egal
cu 14 Haideți luăm un exemplu trebuie
să calculăm ca b și pe care ai
baza conjugată a acidului formic
Cunoscând valoarea Constantin sale
de aciditate și evaluarea pe ca
a valoarea constantei de aciditate
este 17 ori 10 la cinci moli pe
litru iar valoarea exponentului
de aciditate este 3 baza conjugată
a acidului formic este Ionuț formiat
și Aplicând relațiile replicare
tocmai am discutat si de muncă
este extrem de simplu o să aflăm
valoarea constantei de bazicitate
să nu uităm unitățile de măsură
moli pe litru la puterea a doua
în cazul produsul ionic al apei
și moli pe litru în cazul Constantin
viața City tate așa dar aici se
reduce și obținem Constanta de
bazicitate egal cu 5 ori 10 la minus
11 mai pe litru iar în cazul Spune
tu lui de bazicitate e punctul
de bazicitate este egal cu 14 minus
exponentul de aciditate și este
egal cu 10 zeci și cinci

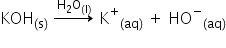
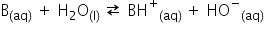
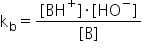
 HO- + H3O+
HO- + H3O+




