Echilibre chimice – aplicaţie
Partajeaza in Google Classroom
Teorie: Echilibre chimice – aplicaţii Descarcă PDF
Echilibre chimice – aplicaţii
Starea de echilibru chimic este descrisă, pe scurt, în felul următor:
- Viteza reacţiei directe este egală cu viteza reacţiei inverse;
- Concentraţiile substanţelor implicate în reacţie sunt stabilizate la valori bine determinate.
Adesea, într-un laborator de chimie, se cunosc cantităţile de substanţă disponibile pentru reacţiile chimice. Ceea ce trebuie să aflăm, prin calcul, sunt cantităţile exacte de substanţe prezente la echilibru. Pentru acest tip de calcul se poate folosi metoda descrisă în continuare.
Exemplu de calcul – Într-un vas de 4L se introduc 4 moli de hidrogen şi 8 moli de iod. Care este compoziţia la echilibru pentru reacţia dintre hidrogen şi iod? Se cunoaşte K = 794 pentru T = 298K.
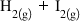

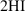

___________________________
Compoziţia la echilibru = ?
- Mai întâi aflăm concentraţiile iniţiale ale speciilor chimice participante la reacţie: concentraţiile reactanţilor le aflăm prin calcul, iar în cazul produsului de reacţie, concentraţia iniţială este 0M, având în vedere că, iniţial, nu există niciun mol de HI în vasul de reacţie.
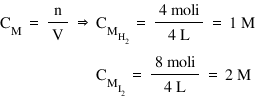
- Apoi completăm următorul tabel:
|
Ecuaţia reacţiei |
H2(g) + I2(g) |
|
Concentraţia iniţială |
1 M 2 M 0 M |
|
Concentraţia modificată |
- x M - x M + 2x M |
|
Concentraţia la echilibru |
(1-x) M (2-x) M 2x M |
– unde x reprezintă cantitatea de reactanţi care se consumă pentru a forma HI în condiţiile date de temperatură şi presiune.
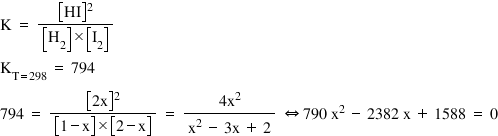
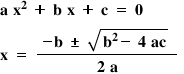
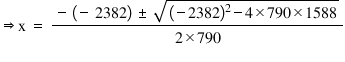

- Pentru a afla concentraţiile substanţelor la echilibru, înlocuim în tabel, pe rândul corespunzător, valoarea lui x cu 0,995 mol/L. Astfel obţinem compoziţia la echilibru.
|
Ecuaţia reacţiei |
H2(g) + I2(g) |
|
Concentraţia iniţială |
1 M 2 M 0 M |
|
Concentraţia modificată |
- x M - x M + 2x M |
|
Concentraţia la echilibru |
0,005 mol/L 1,005 mol/L 1,99 mol/L |
Cunoaşterea valorii lui K permite să se prevadă sensul în care se produce reacţia chimică:
- K > 1 – sistemul este deplasat spre dreapta: este favorizată formarea produşilor de reacţie;
- K < 1 – sistemul este deplasat spre stânga: este favorizată existenţa reactanţilor, şi nu formarea produşilor de reacţie;
- K = 1 – toate speciile chimice sunt la echilibru în aceeaşi proporţie, echilibrul nu e deplasat în nicio direcţie.
Echilibrele chimice pentru care valoarea lui K este mult mai mare decât 1 (cel puţin de ordinul 103) pot fi considerate, în practică, reacţii totale.
Reacţiile totale sunt reacţii în care întreaga concentraţie de reactanţi este convertită în cadrul reacţiei chimice în produşi de reacţie.






