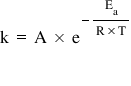Printre factorii care influenţează viteza unei reacţii chimice se numără:
- concentraţia reactanţilor;
- suprafaţa de contact;
- temperatura;
- prezenţa catalizatorilor.
Influenţa suprafeţei de contact asupra vitezei de reacţie:
Mărirea suprafeţei de contact dintre reactanţi duce la mărirea vitezei de reacţie.
Într-un amestec solid, viteza de reacţie este foarte mică; în schimb, atunci când reactanţii se găsesc în soluţie, reacţia are loc cu viteză foarte mare. Aşadar, viteza reacţiilor chimice este mai mare în fază lichidă decât în fază solidă.
Influenţa temperaturii asupra vitezei de reacţie:
Viteza tuturor reacţiilor chimice creşte odată cu creşterea temperaturii.
În expresia vitezei de reacţie (v = k x cn), constanta de viteză, k, este factorul dependent de temperatură: pe măsură ce temperatura creşte, creşte şi valoarea lui k.
Relaţia lui Arrhenius redă dependenţa constantei de viteză de temperatură:
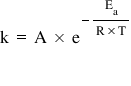
A – factor pre-exponenţial care e o constantă specifică fiecărei reacţii chimice;
e – constantă matematică, e la puterea (– Ea/RT) este factorul exponenţial al relaţiei;
Ea – energia de activare;
R – constanta gazelor ideale (R = 8,31 J/mol x K);
T – temperatura absolută.
Factorul exponenţial din relaţia lui Arrhenius reprezintă probabilitatea ca o ciocnire oarecare să fie eficientă.
Factorul pre-exponenţial din relaţia lui Arrhenius reprezintă numărul total de ciocniri pe secundă (indiferent dacă sunt eficiente sau nu).
Constanta de viteză, k, adică produsul dintre cei doi factori, reprezintă viteza ciocnirilor eficace.
Energia de activare, Ea, a unei reacţii poate fi determinată cu ajutorul relaţiei lui Arrhenius, fie prin calcul, fie utilizând metoda grafică. Pentru efectuarea acestor calcule este nevoie de cunoaşterea valorilor constantei de viteză la diferite temperaturi.