Poziţia elementelor în tabelul periodic şi proprietăţile periodice
Partajeaza in Google Classroom
Teorie: Teorie - Poziția elementelor în tabelul periodic și proprietățile periodice Descarcă PDF
Poziția elementelor în tabelul periodic și proprietățile periodice
Proprietățile elementelor chimice sunt împărțite în două categorii principale, după modul în care variază în tabelul periodic: proprietăți periodice și proprietăți neperiodice.
- Proprietăți periodice: proprietăți care se repetă după un anumit număr de elemente (se repetă periodic). Repetarea periodică a proprietăților elementelor din aceeași grupă se datorează completării cu electroni – structura stratului exterior a elementelor variază periodic. Aceste proprietăți sunt:
- Chimice:
- Valența;
- Electronegativitatea;
- Caracterul metalic;
- Caracterul nemetalic;
- Fizice:
- Volumul atomic;
- Raza atomică;
- Volumul ionic;
- Raza ionică;
- Energia de ionizare.
- Chimice:
- Proprietăți neperiodice: proprietăți care variază continuu de la un element la altul și nu se repetă deloc; sunt proprietățile specifice fiecărui element în parte. Acestea sunt:
- Numărul atomic, Z;
- Numărul de masă, A.
Variația proprietăților periodice fizice în tabelul periodic
Volumul atomic este distanța dintre nucleul unui atom și electronii de valență (electronii cei mai îndepărtați de nucleu). Pentru că poziția electronilor în învelișul electronic este o funcție de probabilitate, această distanță nu este o măsură precisă. Așadar, pentru mai multă precizie, s-a introdus noțiunea de rază atomică.
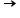 Variația volumului atomic în tabelul periodic: crește de sus în jos în grupă și scade de la stânga la dreapta în perioadă. Volumele atomice ale elementelor tranziționale sunt foarte mici.
Variația volumului atomic în tabelul periodic: crește de sus în jos în grupă și scade de la stânga la dreapta în perioadă. Volumele atomice ale elementelor tranziționale sunt foarte mici.
Raza atomică (ra) a unui element în stare solidă este jumătate din distanța dintre nucleele a doi atomi vecini dintr-o probă de material solid. Definiția este valabilă numai pentru solide, deoarece pentru măsurare este nevoie de doi atomi identici legați între ei, însă e bine să se țină cont de faptul că toate elementele pot fi aduse în stare solidă, iar unele elemente (în special metale) sunt solide la temperatura camerei.
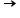 Variația razei atomice în tabelul periodic: crește de sus în jos în grupă și scade de la stânga la dreapta în perioadă. Razele atomice ale elementelor tranziționale sunt foarte mici.
Variația razei atomice în tabelul periodic: crește de sus în jos în grupă și scade de la stânga la dreapta în perioadă. Razele atomice ale elementelor tranziționale sunt foarte mici.
Ionii sunt specii chimice pentru care numărul protonilor din nucleu este diferit de numărul electronilor din învelișul electronic. Acest lucru face ca ionii să aibă sarcină electrică diferită de zero.
Pentru a ajunge la o configurație stabilă, unii atomi neutri (care au sarcina electrică egală cu zero) acceptă sau cedează electroni:
- Când un atom cedează/pierde un număr n de electroni, atomul neutru se va transforma într-un ion pozitiv care se mai numește și cation. În acest caz: nr. p+ > nr. e-
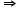 sarcina pozitivă, n+
sarcina pozitivă, n+
E – ne- 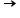 En+
En+
- Când un atom câștigă/primește un număr n de electroni, atomul neutru se va transforma într-un ion negativ care se mai numește și anion. În acest caz: nr. p+ < nr. e-
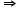 sarcina negativă, n-
sarcina negativă, n-
E + ne- 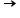 En-
En-
Raza ionică
- Raza cationilor este mai mică decât raza atomilor din care provin cationii: ri+ < ra
- Raza anionilor este mai mare decât raza atomilor din care provin anionii: ri- > ra
Pentru un element E, : ri+ < ra < ri-
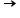 Variația razei ionice în tabelul perodic: crește în grupă de sus în jos, și scade în perioadă de la stânga la dreapta.
Variația razei ionice în tabelul perodic: crește în grupă de sus în jos, și scade în perioadă de la stânga la dreapta.






