Poziţia elementelor în tabelul periodic şi proprietăţile periodice
Partajeaza in Google Classroom

Transcript
între poziția elementelor în tabelul
periodic despre care am dat data
trecută și proprietățile elementelor
există niște legături foarte clare
despre care vom afla mai multe
în lecția aceasta mai întâi Haideți
să ne reamintim corelația dintre
configurația electronică a unui
element și poziția sa în tabelul
periodic Spre exemplu un metal
alcalin potasiul cu numărul Atomic
net egal cu 19 Deci asta are 19
RON dispuși 1 S2 2 S2 2p 6 3S 2
3 pe 6 și 4 s după numărul stratului
de valență determină perioada Deci
în acest caz este vorba de perioada
a patra iar după numărul electronilor
din stratul de valență determinăm
numărul grupei 10 de vorba de grupa
întâi principale sau mai putem
nota cu 1a să vedem ce se întâmplă
și în cazul unui element din blocul
de vom lua exemplul vanadiului
care are numărul Atomic z 23 Deci
vanadiul are 23 de electroni și
următoarea configurație 1 S2 2
S2 2p 6 3S 2 3 pe 6 4 este 2 3
d 3 Așadar după numărul fratelui
exterior cel mai depărtat de nucleu
rezultă că ne aflăm tot în perioada
iar în ceea ce privește grupa pentru
că e vorba despre un element din
blocul D1 lua în considerare electroni
de valență din stratul de valență
electronii din orbitali trăite
adică ultimul electroni în ordinea
de completare a orbitalilor așa
că avem doi 3 grupa a cincea sau
grupa a cincea B să luăm și un
element din blocul pe Spre exemplu
bromul care are numărul Atomic
z este egal cu 35 Deci avem 35
de electroni în învelișul S2 2
S2 2p 6 3S 2 3 pe 6 4 s23 de 10
de completat integral stratul cu
numărul 3 acum continuă completarea
stratului cu numărul 4 și avem
30 de electroni până aici așa că
ne mai rămân cinci electroni pentru
substratul 4p stratul exterior
este stratul 4 Așadar ne aflăm
tot în perioada a patra iar pentru
grupă vom lua în considerare electronii
de valență adică 2 și 5 așa dar
suntem în grupa șaptea principală
sau în grupa 17 putem să luăm în
calcul și cei 10 electroni din
substratul 3D fiecare element din
tabelul periodic are proprietăți
unice însă are și proprietăți foarte
asemănătoare cu alte elemente din
anumite grupuri din tabel după
modul în care aceste proprietăți
variază în tabelul periodic ele
sunt împărțite în două mari categorii
avem proprietăți periodice acestea
sunt proprietăți diferite la mai
multe elemente dar se repetă după
un anumit număr de elemente și
mai avem proprietățile neperiodice
acestea sunt proprietățile care
variază continut de la un aliment
la altul și nu se repetă deloc
Deci proprietățile neperiodice
sunt acelea care elementul parte
dacă ne uităm la ei tabelul periodic
au observat că nu există mai multe
elemente cu același număr atomic
z sau cu o același număr de masă
a Așadar zeci a sunt proprietățile
periodice în schimb proprietățile
periodice cele care se repetă după
un anumit număr de elemente adică
cele care se repetă periodic conform
legii periodicității formulate
inițial de Mendeleev formulate
inițial de Mendeleev proprietățile
elementelor chimice sunt funcții
periodice de numărul Atomic repetare
a periodică a Proprietăților elementelor
dintre o grupă se datorează completării
cu electroni a straturilor care
se repetă periodic adică structura
stratului exterior variază Terios
ca să înțelegem mai bine Haide
să ne uităm la grupele 1 și 2 avem
completarea substratului exterior
n s adică pentru Gruparea principală
1 S1 e13 s14s 1 apoi pentru elementele
din grupa a doua principală straturile
exterioare sunt 2 2 2 3 2 4 x 2
și tot așa până la 7:00 s21 S2
este heliul care din motive de
stabilitate a fost Grupați cu gazele
nobile cate elemente au toate electronii
de valență într un orbital de tip
fitinguri în cazul grupa întâi
a fi cuplați în cazul grupei a
doua face ca aceste elemente să
aibă proprietățile are Adică Metalele
alcaline și la fel și acestea adică
metale ecris la pământ oase valabil
pentru toate grupele proprietățile
care variază periodic pot fi chimice
sau pot fi proprietăți fizice câteva
dintre proprietățile chimice sunt
valența electronegativitatea caracterul
metalic și caracterul nemetalic
proprietățile fizice și volumul
Atomic raza atomică volumul ionic
și raza Ionică și energia de ionizare
semnalizăm acum variația câtorva
proprietăți fizice ale elementelor
începe cu volumul Atomic adică
cu dimensiunea tot volumul atomului
se referă la distanța dintre nucleul
unui atom și electronii de valență
dar dacă vă mai amintiți am discutat
prin primele lecții despre comuna
electron poate apărea oriunde pentru
că poziția electronului în timp
și spațiu este de fapt o funcție
de probabilitate Deci atom nu are
o dimensiune fix atunci când am
vorbit despre orbitali am spus
că electroni se găsesc pentru anume
zonă cu o probabilitate de 90%
și cu o probabilitate mult mai
mică în afara acestei zone așa
că ne bazăm pe Probabilitatea de
90% de a găsi electronul întru
anumită zonă sferică din jurul
atomului și astfel măsura volumul
sau pentru mai multă precizie să
Definiți noțiunea de raza atomică
definiție a fost dată pentru razele
atomilor din metale adică din sărite
Deci raza atomică a unui element
metalic este jumătate din distanța
dintre nucleele a doi atomi vecin
dintre o probă de material solid
asta distanță corespunde la două
razei atomice iar aceasta la o
singură raza tu definiția e valabilă
numai pentru solidă pentru că după
cum vedeți pentru măsurare e nevoie
de atomi identici legați între
ei structura bine de astfel de
atomi se găsesc cel mai des în
metale care sunt o aglomerare de
atomi identici si și în partea
electronică vedem Și cum variază
volumul Atomic și raza atomică
în tabelul periodic Pe măsură ce
coborâm între o grupă dimensiunea
atomului crește având în vedere
că adăugăm din ce în ce mai multe
niveluri de energie ocupate cu
electroni acum un lucru care numai
la fel de simplu de dus este ceea
ce se întâmplă când mergem spre
dreapta întru perioadă când merge
spre dreapta adăugăm electroni
dar îi adăugăm pe aceeași stradă
Deci avem nucleul și eu strat care
se tot Completează cu electroni
Pe măsură ce evoluăm perioadă Bineînțeles
nu toți orbitalii dintre un strat
sunt fericit dar vom folosi această
schemă foarte simplificată Pe măsură
ce evoluam în perioadă nucleul
are și el tot mai mulți protoni
de sarcină pozitivă protonilor
din nucleu care devine din ce în
ce mai puternică a trage electronii
din ce mai aproape de nucleu așa
că Pe măsură ce mergem spre dreapta
Iar nucleul are din ce în ce mai
mulți protoni dimensiunea atomilor
scade volumele și razele atomice
variază la fel în tabelul periodic
în cazul elementelor din grupele
principale după cum se poate vedea
în această imagine le cresc grupă
de sus în jos coadă perioadă de
la stânga la dreapta corespunzător
creșterii sarcini nucleare elementele
tranzitionale situate în zona centrală
a tabelului periodic atomice mici
datorită completării cu electroni
a orbitalilor 3D sau 40 situați
în interiorul învelișului electronic
precum și datorită existenței unei
sarcini cam asta ar fi Despre dimensiunea
atomilor continuare vom discuta
și despre variația altul proprietăți
fizice precum raza Ionică și energia
de ionizare însă mai întâi trebuie
să înțelegem Ce sunt ionii și să
înțelegem diferența dintre atomii
și atomii sunt specii chimice care
au sarcina electrică neutră pentru
că numărul de protoni din nucleu
este egal cu numărul de electroni
din învelișul de spunem ca o sarcină
electrică 0 sau neutru pe cine
chimice pentru care numărul protonilor
din nucleu e diferit de numărul
electronilor din înveliș sunt ionii
atomi își doresc cu toții să ajungă
la configurație cât mai stabile
precum populația de aceea ei primesc
sau cedează electroni de la aici
sau în comun electroni din ultimul
strat sau chiar din ultimele strat
Deci când un atom neutru pe care
îl vom nota cu e mai departe acceptă
sau cedează electroni este transformă
într un Ioan există Ion pozitiv
și negativ când un atom pierde
sau cedează electroni se va transforma
în Ioni pozitivi sau Casio când
un atom câștigă sau primește un
număr n de electroni este de transformă
în Ioni negativi sau întruna Neos
Deci în cazul cationilor sau Ionel
opoziției dacă atomul cedează niște
electroni înseamnă că numărul protonilor
din nucleu va fi mai mare decât
numărul de electroni din un pic
și astfel niște sarcini pozitive
din nucleu nu mai sunt neutralizate
de acolo simbolul plus al cationilor
în cazul anionilor sau al ionilor
negativ în momentul în care atomul
primește niște numărul protonilor
din nucleu devine mai mic decât
numărul electronilor de medici
adică nucleul nu mai are o sarcină
pozitivă îndeajuns de mare încât
să ne utilizeze numărul mărit de
așa că per total atomul se va transforma
în sarcina negativă Adică acum
că am stabilit Ce sunt eu Oni Haideți
să vedem Și ce se întâmplă cu dimensiunea
tu 1.008 supă ce acceptă sau cedează
electroni adică să vorbim puțin
și despre raza Ion să luăm niște
exemple concrete atomul de sodiu
are 11 RON RON și 11 protoni pentru
a ajunge la o configurație stabilă
de octet pe stratul cu numărul
2 deschis și configurația solului
1 s22 s22 612 ajunge la configurația
de octet pe stratul 2 atomul de
sodiu vrea să scape de un așa că
vă dau un electron către un alt
atom care probabil mai are nevoie
doar de unde electron pentru a
ajunge la acum salvarea asta Cine
a fost 111 protoni și 10 Electro
vedem că diferența dintre numărul
de electroni și numărul de protoni
este de de sarcina ionului este
plus unu adică sarcina este egală
cu numărul de electronice Dar cât
despre dimensiune în ionul pozitiv
numărul de electroni care se rotesc
în jurul nucleului e mai mic decât
în cazul atomului dar sarcina nucleului
rămâne aceeași În consecință electroni
rămas și în învelișul electronic
al ionului punct vor fi atrași
mai puternic de nucleu astfel vor
fi mai aproape de nucleu Deci raza
ionului pozitiv e mai mică decât
raza atomului din care provine
să luăm fiecare are 17 RON și următoarea
configurație 1 S2 2 S2 2p 6 3S
2 și 3 pe 5 din configurații observăm
că clorului mai lipsește un singur
electron pentru a ajunge la configurație
de octet pe stratul 3 pentru aceasta
clorul va fi electroni poate chiar
de la sodiu care își dorește să
scape de unde Electro Deci clorul
care are 17 protoni și 17 elevi
primește un electron și a astfel
va avea 17 protoni și 18 electroni
de aici o sarcina negativă vedem
că diferența dintre numărul protonilor
și ale lectron este de un electronist
fel de clor se transformă în Ion
clor minus ca și o scurtă paranteză
atunci când vine vorba de notație
în cazul sarcinilor sau nu e suficientă
notația și revenind la clor sarcină
electrică acestuia va fi egală
cu unu adică cu numărul de electroni
în cazul ionilor negativi numărul
electronilor care se rotesc în
jurul nucleului e mai mare decât
sarcină pozitivă a acestuia în
plus electroni mai numeroși acum
respinge mai tare uit pe alții
10 la zi mai mare decât raza atomului
din care în general razele ionice
cresc pentru elementele din fiecare
perioadă de la dreapta de la grupa
18 la stânga spre grupa întâia
principală în grupă razele ionice
cresc de sus în jos pentru un element
raza ionului pozitiv este mai mică
decât raza atomică care la rândul
ei este mai mică decât raza ionului
negativ și lecția viitoare va avea
legătură cu Johnny mai precis vom
afla cum variaza energia de ionizare
în tabelul periodic

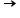 Variația volumului atomic în tabelul periodic: crește de sus în jos în grupă și scade de la stânga la dreapta în perioadă. Volumele atomice ale elementelor tranziționale sunt foarte mici.
Variația volumului atomic în tabelul periodic: crește de sus în jos în grupă și scade de la stânga la dreapta în perioadă. Volumele atomice ale elementelor tranziționale sunt foarte mici.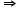 sarcina pozitivă, n+
sarcina pozitivă, n+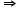 sarcina negativă, n-
sarcina negativă, n- En-
En-




