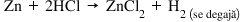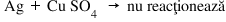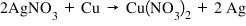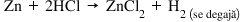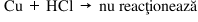În funcţie de caracterul oxido-reducător, metalele au fost aranjate în seria activităţii metalelor. Această ordonare a fost făcută pe baza rezultatelor experimentale.
Hidrogenul apare în seria activităţii metalelor ca termen de comparaţie pentru reactivitate.

Reactivitatea unui metal se datorează diferenţei dintre stabilitatea configuraţiilor electronice ale metalului când acesta e sub formă de atomi, sau când metalul este sub formă de ioni. De exemplu, metalele care trebuie să piardă un singur electron pentru a forma ioni stabili în cadrul unui compus chimic sunt mult mai reactive decât metalele care ar trebui să cedeze mai mulţi electroni. De aceea, metalele din grupa 1 sunt cele mai reactive.
Seria activităţii metalelor poate fi folosită pentru a prezice comportamentul metalelor în reacţii de substituţie, în reacţiile metalelor cu apa, sau în reacţiile metalelor cu acizii.
Reacţia de substituţie sau reacţia de simplă înlocuire este reacţia chimică prin care un atom dintr-o substanţă simplă înlocuieşte un atom dintr-o substanţă compusă.
Exemplu – Reacţia argintului cu sulfatul de cupru:
În seria activităţii metalelor, uitându-ne la poziţia Ag şi a Cu, observăm că Ag este mai departe de H2 decât Cu. Asta înseamnă că este şi mai puţin reactiv decât Cu, deci Ag nu poate să substituie Cu din sulfat.
În concluzie: 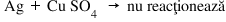
Exemplu – Reacţia cuprului cu nitratul de argint:
Conform seriei activităţii metalelor, Cu este mai reactiv decât Ag. Astfel, Cu poate înlocui Ag din nitratul de argint.
În concluzie: 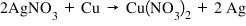
Exemplu – Reacţia metalelor cu acidul clorhidric:
În seria activităţii metalelor, Zn se află înaintea hidrogenului, iar Cu se află după hidrogen. Aşadar, în reacţia cu HCl, Zn poate înlocui hidrogenul din molecula de acid, formând o clorură, în timp ce hidrogenul astfel eliberat se degajă din mediul de reacţie.
În concluzie: