Tăria acizilor şi bazelor – amfoliţi acido-bazici
Partajeaza in Google Classroom
Teorie: Teorie - Tăria acizilor şi bazelor. Amfoliţi acido-bazici. Descarcă PDF
Tăria acizilor şi bazelor. Amfoliţi acido-bazici.
Criteriul tăriei acido-bazice este cel mai important criteriu de clasificare pentru practică al acizilor şi bazelor.
Conform tăriei acido-bazice, acizii se clasifică în două mari categorii: acizi tari şi acizi slabi.
Un acid tare disociază complet în apă, într-un proton şi un anion; protonul se leagă de o moleculă de apă, formând un ion hidroniu (H3O+). Reacţia este considerată ireversibilă şi se reprezintă cu o singură săgeată deoarece în soluţie nu se mai găsesc deloc molecule de acid – acestea au ionizat complet.
6 acizi sunt consideraţi ca fiind acizi tari:
- HCl – acidul clorhidric;
- HNO3 – acidul azotic;
- H2SO4 – acidul sulfuric;
- HBr – acidul bromhidric;
- HI – acidul iodhidric;
- HClO4 – acidul percloric.
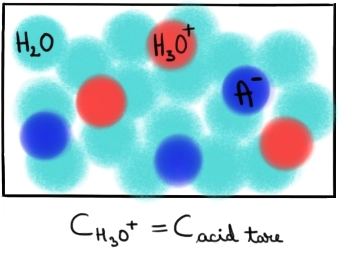
Reprezentarea schematică a ionizării acizilor tari în soluţie apoasă:
|
|
Acidul tare HA disociază complet în soluţia apoasă în ionul A- şi într-un proton care imediat se leagă de o moleculă de apă, formând ionul hidroniu, H3O+. Concentraţia ionilor H3O+ este egală cu concentraţia acidului tare HA. |
Exemplu – dizolvarea HNO3 0,5 M în apă:
HNO3 + H2O  NO3- + H3O+
NO3- + H3O+
CHNO3 = CH3O+ = 0,5 moli/L
Un acid slab ionizează parţial în soluţie apoasă (nu disociază complet); ionii abia formaţi pot să reacţioneze între ei pentru a reface acidul. Reacţia este reversibilă şi se notează cu două săgeţi, în sensuri opuse, datorită celor două procese care se desfăşoară în sensuri opuse: reacţia directă de ionizare a acidului prin care se obţin anioni şi ioni hidroniu, şi reacţia inversă de refacere a acidului slab şi a apei din ionii prezenţi în soluţie.
Reprezentarea schematică a ionizării acizilor slabi în soluţie apoasă:
|
|
Într-o soluţie apoasă de acid slab coexistă molecule de acid, notate cu HA, anionii corespunzători, A-, şi ioni hidroniu, H3O+. Ionizând parţial, acizii slabi duc la obţinerea unei concentraţii mai mici de ioni hidroniu decât concentraţia acidului introdus în soluţie. |
Clasa acizilor slabi conţine un număr foarte mare de acizi, printre care: HF (acidul fluorhidric), H2CO3 (acidul carbonic), H2S (acidul sulfhidric), HNO2 (acidul azotos), CH3COOH (acidul acetic), etc.
Constanta de aciditate, Ka, este o mărime care caracterizează tăria unui acid. Cu cât această constantă e mai mare, cu atât acidul va ceda H+ mai uşor.
Calculul constantei de aciditate: valoarea constantei de aciditate, Ka, se obţine înmulţind constanta de echilibru, K, a reacţiei unui acid slab cu apa, cu concentraţia apei.
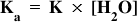
Exemplu - Aflarea constantei de aciditate pentru acidul cianhidric:
HCN + H2O  CN- + H3O+
CN- + H3O+
- pentru a obţine constanta de echilibru, aplicăm legea acţiunii maselor:
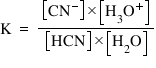
- apoi aplicăm relaţia de calcul pentru Ka:
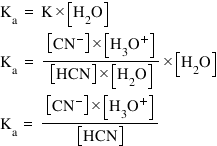
Conform tăriei acido-bazice, bazele se clasifică în două mari categorii: baze tari şi baze slabe.
Bazele tari disociază complet în soluţie apoasă, formând cationi hidrataţi şi ioni hidroxil. Bazele tari acceptă protoni foarte uşor.
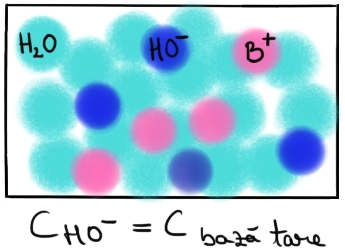
Reprezentarea schematică a ionizării bazelor tari în soluţie apoasă:
|
|
Într-o soluţie apoasă, la dizolvarea unei baze tari, BOH, se găsesc cationii B+ şi ionii hidroxil HO- în care a disociat baza tare. Concentraţia ionilor HO- într-o astfel de soluţie este egală cu concentraţia bazei tari, BOH, introduse în soluţie. |
Din categoria bazelor tari fac parte hidroxizii metalelor alcaline şi câţiva hidroxizi ai metalelor alcalino-pământoase. Spre exemplu, LiOH (hidroxidul de litiu), NaOH (hidroxidul de sodiu), KOH (hidroxidul de potasiu), sau Ba(OH)2 (hidroxidul de bariu) sunt baze tari.
Bazele slabe nu ionizează complet în soluţie apoasă şi acceptă mai greu protoni, astfel că în soluţiile apoase de baze slabe coexistă molecule de bază cu cationii şi cu ionii hidroxil în care au disociat unele molecule de bază.
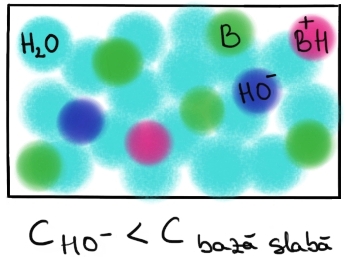
Reprezentarea schematică a disocierii bazelor slabe în soluţie apoasă:
|
|
Baza slabă este notată cu B, deoarece există şi baze care chiar dacă nu sunt hidroxizi (deci nu pot elibera HO- prin disociere), reacţionează în schimb cu apa, formând astfel HO-. În soluţie sunt prezente molecule de bază slabă, B, cationii B+H şi ionii HO-. Concentraţia ionilor HO- este mai mică decât concentraţia de bază slabă care a fost introdusă în soluţie. |
Din categoria bazelor slabe fac parte NH3 (amoniacul), N2H4 (hidrazina) sau anionii acizilor slabi precum CN- (ionul cianură) sau CO32- (ionul carbonat).
Constanta de bazicitate, Kb, este o mărime care caracterizează tăria unei baze. Cu cât valoarea Kb este mai mare, cu atât baza acceptă protoni mai uşor (este mai tare).
Calculul constante de bazicitate: valoarea constantei de bazicitate, Kb, se obţine înmulţind constanta de echilibru, K, a reacţiei unei baze slabe cu apa, cu concentraţia apei.
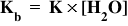
Caracterul amfoter se referă la capacitatea anumitor substanţe de a reacţiona atât cu acizi, cât şi cu baze, deci de a avea atât caracter bazic, cât şi caracter acid. Aceste substanţe se numesc amfoliţi acido-bazici. Exemple de amfoliţi acido-bazici sunt apa, dar şi hidroxizii unor metale precum Al(OH)3 sau Zn(OH)2.
Apa ca amfolit acido-bazic:
Caracterul amfoter al apei este motivul pentru care apa acţionează ca cel mai bun solvent atât pentru acizi cât şi pentru baze.
O moleculă de apă poate ceda un proton, fiind deci un acid:
HOH  H+ + HO-
H+ + HO-
Molecula de apă poate şi să accepte un proton, fiind deci o bază:
H+ + HOH  H3O+
H3O+
Reacţia globală de ionizare a apei este următoarea:
2H2O  H3O+ + HO-
H3O+ + HO-