Răspândire în natură. Aluminiul este cel mai răspândit metal în natură; el alcătuiește 8,1% din scoarța pământului. Aluminiul nu există în stare nativă. Dintre mineralele de aluminiu, mai importante sunt:
micele (alumino-silicați de fier și de magneziu sau de metale alcaline),
feldspații (alumino-silicați de potasiu sau de sodiu, K[AlSi
3O
8], respectiv Na[AlSi
3O
8]) și produsele de alterare ale acestora:
caolinul și
argila, (Al
2O
3·2SiO
2·2H
2O), corindonul (oxidul de aluminiu, Al
2O
3) și varietățile lui, bauxita - oxidul de aluminiu hidratat, AlO(OH), apoi
criolitul - fluoroaluminatul de sodiu, Na
3[AlF
6], etc.
Importante zăcăminte de bauxită există în Franța (în localitatea Les Beaux, de unde se trage și numele de bauxită), Ungaria, Rusia, India, S.U.A.. În România, zăcămintele de bauxită sunt în munții Apuseni.
Obținere. Fabricarea aluminiului cuprinde două etape: I) fabricarea oxidului de aluminiu (alumină); II) obținerea aluminiului din alumină.
I) Fabricarea oxidului de aluminiu. Aluminiul, mai ales cel destinat construcțiilor de avioane, nu trebuie să conțină nici fier, nici siliciu. De aceea, când bauxitele conțin cantități mai mari de fier și siliciu, ele trebuie supuse unor tratamente prealabile de purificare.
Procedeul Bayer este unul dintre cele mai răspândite procedee pentru fabricarea aluminei din bauxite sărace în fier și silice. În acest procedeu, bauxita, în prealabil calcinată și măcinată,, este tratată cu hidroxid de sodiu, în autoclave, la 4-6 atm și 160-180°C. Oxidul de aluminiu din bauxită trece în soluție sub formă de aluminat de sodiu, Na[Al(OH)4]. Amestecul se filtrează, separându-se soluția de aluminat de sodiu de hidroxizii de fier și de combinațiile siliciului cu aluminatul de sodiu (care formează așa-numitele “noroaie roșii’). În soluția cu aluminatul de sodiu se introduce fie un curent de dioxid de carbon, când precipită hidroxidul de aluminiu:
2Na[Al(OH)4] + CO2 = 2Al(OH)3 + Na2CO3 + H2O
fie cantități mici de Al(OH)3, care amorsează descompunerea aluminatului având rol de germen de cristalizare pentru separarea hidroxidului de aluminiu:
Na[Al(OH)4] → Al(OH)3 + NaOH
Hidroxidul de aluminiu obținut se calcinează în cuptoare rotative la 1200°C când trece în oxid de aluminiu:
Na[Al(OH)4 → Al2O3 + 3H2O
Noroaiele roșii rămase de la separarea hidroxidului de aluminiu conțin, în afară de oxizi de fier și silice, oxid de titan și oxid de vanadiu, a căror extragere este o problemă luată în considerare.
Un conținut mai mare de siliciu în bauxită (peste 5%) este dăunător, deoarece silicea trece în Al2O3, de unde poate pătrunde în aluminiul metalic. De aceea, asemenea bauxite trebuie îmbogățite în Al2O3, ceea ce se realizează în instalații speciale de spălare.
II) Obținerea aluminiului din alumină. Oxidul de aluminiu nu poate fi redus cu cărbune, deoarece s-ar forma carbura de aluminiu, Al
4C
3; de aceea se folosește electroliza topiturii de oxid de aluminiu. Cum însă alumina are un punct de topire foarte ridicat (2050°C), în topitură de adaugă drept fondant criolit (și, uneori, fluorină), care scade temperatura de topire la 980°C. Se lucrează la intensități de curent de peste 50 000A.
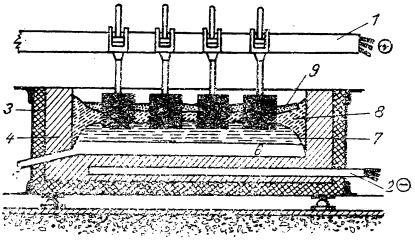
Celula electrolitică este formată dintr-o cuvă de oțel căptușită cu blocuri de grafit ce constituie catodul; anodul este alcătuit tot din blocuri de grafit suspendate în topitură (după cum e ilustrat în figura de mai jos).
Celulă electrolitică pentru fabricarea aluminiului:
1 - anod; 2- catod; 3 - izolația termică; 4 - căptușeală cu grafit;
5 - canal pentru scurgerea aluminiului topit; 6 - aluminiu topit;
7 - oxid de aluminiu cu criolit; 8 - electrolit solid; 9 - crustă.
Prin trecerea curentului electric, aluminiul se adună în jurul catodului la fundul celulei, de unde este scos periodic, iar oxigenul este pus în libertate la anod, unde se unește cu carbonul electrodului formând oxizi de carbon. Anodul fiind consumat, trebuie înlocuit din când în când.
Aluminiul obținut este impur și trebuie rafinat. Pentru obținerea unui aluminiu foarte pur, cu 99,90-99,99% Al, se folosește rafinarea electrolitică.
Proprietăți fizice. Aluminul este un metal alb-argintiu, care cristalizează în sistemul cubic cu fețe centrate. Este un metal ușor, mai puțin dur decât cuprul. Aluminul este un foarte bun conducător de căldură și electricitate. Conductibilitatea electrică și cea termică sunt aproximativ pe jumătate față de cupru. Aluminiul este foarte plastic; poate fi laminat sau bătut în foi foarte subțiri și tras în sârmă fină.
Proprietăți chimice. Aluminul este un element activ din punct de vedere chimic. Deși are caracter puternic electropozitiv, la temperatură obișnuită aluminiul pur devine stabil în aer, deoarece este apărat de pelicula subțire (0,00001 mm grosime) de oxid de aluminiu format la suprafața lui. Tot așa de stabil este față de apă; pelicula de oxid este formată în urma reacției dintre aluminiu și vaporii de apă din atmosferă.
Formarea peliculei de oxid de aluminiu care protejează metalul de acțiunea aerului și umezelii poate fi împiedicată prin amalgamarea suprafeței aluminiului. De aceea, o bucată de tablă de aluminiu amalgamată prin frecarea suprafeței cu o soluție concentrată de clorură mercurică sau pulbere de oxid de mercur, sau, direct, cu mercur, expusă la aer, se acoperă cu eflorescențe albe datorate formării hidroxidului de aluminiu (sub influența umidității din aer).
Încălzit până la 700°C, aluminul în pulbere arde în aer cu lumină strălucitoare, formând oxid de aluminiu:
4Al + 3O2 = 2Al2O3;  H = -402 kcal/mol
H = -402 kcal/mol
Cantitatea de căldură degajată în această reacție este apreciabilă.
Din cauza afinității mari a aluminiului pentru oxigen, el îl scoate din oxizii metalelor mai puțin active. De exemplu, dacă un amestec format din pulbere de aluminiu și oxid de fier (amestecul format din pulberea de aluminiu și un oxid de fier se numește termit) este aprins, reacția care are loc este extrem de energică, iar căldura degajată ridică temperatura produselor până peste 2000°C:
2Al + Fe2O3 = Al2O3 + 2 Fe;  H = -195 kcal/mol
H = -195 kcal/mol
La această temperatură fierul se topește, iar oxidul de aluminiu se ridică la suprafață. Reacția stă la baza procedeului aluminotermic aplicat la extragerea unor metale (mangan, crom, vanadiu, etc.) din oxizii lor, precum și pentru obținerea temperaturii înalte necesare sudurii fierului.
Aluminul reacționează cu clorul și bromul la temperatură obișnuită, iar cu iodul la încălzire. Cu azotul și carbonul se combină la temperaturi foarte înalte. Cu acizii minerali reacționează la cald, formând sărurile corespunzătoare. Față de acidul azotic este pasiv din cauza formării peliculei de oxid (la fierbere, pasivitatea dispare). Din această cauză, acidul azotic poate fi transportat în vase de aluminiu. Acizii organici (acidul acetic sau acidul citric) îl atacă la temperaturi mai înalte (circa 100°C).
Aluminiul reacționează energic cu hidroxizii alcalini; se formează un hidroxoaluminat și se dezvoltă hidrogen. Reacția se desfășoară în două etape. În prima etapă, pelicula de oxid de aluminiu fiind îndepărtată de soluția de hidroxid alcalin, aluminiul metalic reacționează cu apa; rezultă hidroxidul de aluminiu care, în etapa a doua, cu hidroxidul alcalin, formează hidroxoaluminați, de exemplu:
2Al + 6H2O = 2Al(OH)3 + 3H2
Al(OH)3 + NaOH = Na[Al(OH)4]
Utilizare. Aluminiul împreună cu aliajele sale constituie unul dintre cele mai utilizate metale.
Deoarece la temperatura obișnuită conductibilitatea electrică a aluminiului este de aproximativ jumătate din conductibilitatea electrică a cuprului, iar densitatea este aproximativ de trei ori mai mică decât a cuprului, există din ce în ce mai mult tendința de a se înlocui cablurile electrice de cupru cu cabluri de aluminiu.
Conductibilitatea termică a aluminiului și rezistența sa față de agenți chimici îl fac apt pentru confecționarea de căldări, serpentine, refrigerente, cisterne industriale, vase de menaj, diferite ambalaje, mai ales de medicamente, etc.
Aluminiul topit poate fi pulverizat prin procedeul de metalizare cu flacără oxi-acetilenică și astfel depus pe suprafața altor metale, pe care le protejează; acest procedeu este utilizat la protecția stâlpilor de fontă (contra ruginii), la metalizarea rezervoarelor de oțel, a unor instalații industriale, mai ales a instalațiilor așezate în aer liber, etc. Aluminiul depus prin vaporizare pe sticlă formează o oglindă cu putere bună de reflexie, folosită mai ales pentru telescoape.
Aluminiul este foarte mult folosit pentru alitarea pieselor de fontă sau oțel (alitarea este procedeul de acoperire cu aluminiu a fierului, fontei și oțelului). În acest scop, piesele se scufundă în aluminiu topit sau e încălzesc într-un amestec de pulbere de aluminiu și oxid de aluminiu. Aluminiul pătrunde la suprafața piesei, formând cu fierul o soluție solidă.
În amestec cu azotatul de amoniu și cărbune, aluminiul este folosit drept exploziv (amonal). În chimia organică aluminiul este folosit ca reducător. Prin aluminotermie se obțin metale foarte pure, lipsite de carbon, ceea ce este foarte important pentru folosirea lor în oțeluri speciale.
Aluminiul laminat în foi subțiri servește pentru împachetat alimente, în locul staniului, care este mult mai scump.
Aliaje de aluminiu. Aluminiul, fiind moale ca metal pur, nu poate fi valorificat tehnic ca atare, ci trebuie aliat cu alte metale. Astfel, cuprul îi mărește rezistența la rupere (dar îi scade rezistența la coroziune); magneziul îi mărește rezistența la coroziunea agenților alcalini și a apei de mare; siliciul îi mărește rezistența chimică (dar îi micșorează conductibilitatea electrică) etc.
Aliajele de aluminiu cu circa 4% Cu și cantități mici de Mn și Mg au o mare duritate; ele sunt foarte întrebuințate în tehnica modernă sub denumirea generală de duraluminiu, mai ales în industria aeronautică și a automobilelor. Hidronaliul este un aliaj de aluminiu cu 3-12% Mg, rezistent la acțiunea apei de mare. Magnaliul, aliaj cu compoziția 70-98% Al, 2-30% Mg și mici adaosuri de Sb, Cu, Cr, Ni, se poate suda, nichela, auri și lustrui foarte bine, având și o bună rezistență la rupere. Folosește pentru obținerea oglinzilor incasabile pentru diferite aparate optice, în ceasornicărie, electrotehnică, pentru automobile, etc.
Aliajele de aluminiu cu 12-14% Si, cunoscute sub numele de silumin, se pot trage foarte ușor în fire. Ele sunt mai rezistente la acțiunea acizilor decât aluminiul pur.
În combinațiile sale obișnuite, aluminiul are numărul de oxidare +3, (datorită celor trei electroni de pe stratul electronic exterior). Sărurile e aluminiu cristalizează de obicei cu un număr mare de molecule de apă. Soluțiile apoase ale sărurillor conțin ioni Al3+, incolori, care sunt puternic hidratați (un ion Al3+ poate lega 18H2O). Ele au caracter acid din cauza hidrolizei:
Al3+ + 3H2O = Al(OH)3 + 3H+
Aluminiul manifestă tendința să formeze și combinații complexe. În aceste combinații, valența coordinativă maximă a aluminiului este șase.
Oxidul de aluminiu sau
alumina, Al
2O
3, se găsește în natură cristalizat, incolor (
corindon) sau colorat de diferite impurități în galben (
topaz), în roșu (
rubin), în albastru (
safir), în violet (
ametist), toate varietățile fiind cristale foarte dure (duritatea 9). Emeri, folosit datorită durității sale pentru șlefuit (
șmirghel), este colorat în negru de oxid de fier și de alte impurități.
Oxidul de aluminiu rezultă prin calcinarea hidroxidului de aluminiu sau, în industrie, din bauxită, caolin sau argilă, prin diferite procedee arătate la prepararea aluminiului.
Există diferite modificații cristaline ale oxidului de aluminiu. Modificația obișnuită (
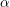
-Al
2O
3) cristalizează în sistemul hexagonal. Sub această formă se găsește corindonul. Modificația cubică a oxidului de aluminiu (
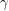
-Al
2O
3) rezultă prin deshidratarea
hidrargilitului sau
boemitului (constituenți ai bauxitei) și are o structură similară spinelilor. Prin încălzire peste 1000°C trece în
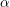
-Al
2O
3, căldura de transformare fiind 20,6 kcal/mol. Așa-numita modificație cristalină
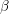
-Al
2O
3 s-a dovedit a fi în realitate un oxid mixt).
Oxidul de aluminiu este stabil din punct de vedere termic, căldura lui de formare fiind foarte mare (

H = -402,3 kcal/mol). Modificația
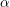
este insolubilă și rezistentă la atacul acizilor diluați; modificația
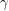
este higroscopică și se dizolvă în acizi.
Oxidul de aluminiu are caracter amfoter: față de baze tari se comportă ca anhidridă acidă; de obicei funcționează însă ca oxid bazic.
Oxidul de aluminiu este folosit la prepararea aluminiului metalic, ca abraziv, la confecționarea de cărămizi refractare, la căptușirea unor cuptoare de temperaturi înalte etc. Oxidul de aluminiu rezultat prin autooxidarea aluminiului amalgamat, fiind foarte activ, este folosit drept catalizator (sau suport de catalizator), absorbant sau schimbător de ioni.
Oxidul de aluminiu se întâlnește și sub formă de oxizi micști, cu alte metale, ca de exemplu în mineralele spinel, MgAl2O4 (adică MgO-Al2O3) și crisoberil, BeAl2O4.
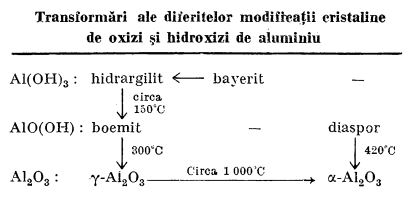
La tratarea soluțiilor de săruri de aluminiu cu amoniac se separă la rece un precipitat gelatinos (cu conținut variabil de apă) de oxid de aluminiu hidratat. În timp, dar mai ales la încălzire, acest hidrogel trece în oxihidroxid de aluminiu AlO(OH), care este cristalin.
Oxihidroxidul de aluminiu se găsește în natură ca mineralul bauxită, rezultat prin dezagregarea silicaților de aluminiu din roci. Oxihidroxidul de aluminiu cristalin, preparat, corespunzător bauxitei, se numește boemit. O altă modificație cristalină a oxihidroxidului de aluminiu este diasporul, care cristalizează în sistemul rombic. Și acesta se găsește în natură ca mineral.
Prin încălzire, oxihidroxidul de aluminiu pierde apa și trece în oxid de aluminiu, și anume: boemitul (bauxita) la 300°C trece în
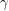
-Al
2O
3, iar diasporul la 420°C trece în
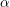
-Al
2O
3 (corindon).
La tratarea soluțiilor de aluminați cu dioxid de carbon se separă un precipitat de natură cristalină, având compoziția Al(OH)3, adică hidroxidul de aluminiu:
2[Al(OH)4]- + CO2 = 2Al(OH)3 + CO32- + H2O
Când precipitarea hidroxidului de aluminiu din soluția de aluminat se face lent și la rece, rezultă
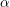
-Al(OH)
3. În această formă se numește
hidrargilit. Hidrargilitul se găsește și în natură ca mineral. Când precipitarea se efectuează cu viteză mare, atunci hidroxidul de aluminiu se separă sub formă de
bayerit,
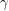
-Al(OH)
3, care este o formă metastabilă. Bayeritul se mai poate obține prin menținerea îndelungată a boemitului în apă sau în soluție diluată de hidroxid alcalin.
Hidrargilitul se dizolvă foarte greu în acizi. Prin încălzire îndelungată, în vas închis, la 150°C, pierde apă și trece în oxihidroxidul de aluminiu, AlO(OH), cristalin.
Mai jos sunt indicate transformări ale diferitelor modificații cristaline de oxizi și hidroxizi de aluminiu:
Hidroxidul de aluminiu are caracter amfoter. Astfel, datorită capacității de a adiționa alți ioni OH-, reacționează cu hidroxizi alcalini formând hidroxoaluminați de tipul [Al(OH)4]-, [Al(OH)5]2- și [Al(OH)6]3-:
Al(OH)3 + OH- = [Al(OH)4]-
Pe de altă parte, ioni H+ (proveniți de la acizi) pot scoate ioni OH- din ionul [Al(OH)4]-. În funcție de concentrația ionilor H+ se stabilesc echilibrele:
[Al(OH)4]- + H+ ⇄ Al(OH)3 + H2O
Al(OH)3 + 3H+ ⇄ Al3+ + 3H2O
Aceste echilibre caracterizează comportarea amfoteră a hidroxidului de aluminiu.
Hidroxidul de aluminiu se întrebuințează la prepararea sărurilor de aluminiu, mai ales a sulfatului și a oxidului de aluminiu, apoi ca mordant în vopsitorie, în industria lacurilor, la purificarea apelor, pentru prepararea cernelurilor de tipar etc.
Dintre sărurile de aluminiu, mai importante sunt fluorura, clorura, sulfatul, silicații și acetatul.
Fluorura de aluminiu, AlF
3, poate fi preparată prin trecerea acidului fluorhidric peste aluminiu sau oxid de aluminiu:
Al + 3HF = AlF3 + 3/2 H2
Al2O3 + 6HF = 2AlF3 + H2O
În stare anhidră este o pulbere albă, insolubilă în apă, acizi și hidroxizi alcalini. Cu fluoruri alcaline formează săruri duble, respectiv săruri complexe, fluoroaluminați. Dintre acestea, importanță tehnică are criolitul, Na3AlF6. Acesta se găsește în natură, dar în mod obișnuit se obține prin tratarea caolinului și sodei cu acid fluorhidric, sau din fluorură de calciu, CaF2. Se folosește ca fondant la obținerea aluminiului în celule electrolitice și ca opacizant în industria sticlei și ceramicii.
Clorura de aluminiu, AlCl
3, se obține anhidră prin trecerea clorului peste aluminiu încălzit sau peste un amestec de oxid de aluminiu și cărbune:
Al2O3 + 3C + 3Cl2 = 2AlCl3 + 3CO
Este o substanță cristalină, higroscopică. Sublimează la 183°C. În apropierea punctului de sublimare, vaporii de clorură de aluminiu sunt bimoleculari, Al2Cl6; pe la 800°C însă, moleculele sunt simple, AlCl3.
La aer fumegă puternic, deoarece hidrolizează din cauza umidității atmosferice:
AlCl3 + 3H2O = Al(OH)3 + 3HCl
Este foarte solubilă în apă; soluția apoasă are caracter puternic acid. Din soluție, clorura de aluminiu cristalizează cu șase molecule de apă.
Clorura de aluminiu este un acid Lewis puternic. Anhidra formează multe combinații de adiție cu diferiți compuși organici (eteri, esteri etc.), ai căror molecule au perechi de electroni neparticipanți (care completează octetul aluminiului). De asemenea formează combinații de adiție și cu compuși anorganici (H2S, SO2, PCl3 etc.). Cu cloruri alcaline formează săruri duble. În chimia organică este folosită în unele reacție speciale (reacții Friedel-Crafts), drept agent de condensare, transmițător de clor, precum și drept catalizator. În cosmetică este folosit ca astringent.
Sulfatul de aluminiu, Al
2(SO
4)
3, se fabrică din caolin sau bauxită, prin tratate cu acid sulfuric. Este o substanță albă, solubilă în apă, cu gust astringent. În urma hidrolizei, soluția are caracter acid. Din soluție cristalizează cu 18 molecule de apă. Cu sulfați alcalini formează sulfați dubli,
alauni.
Sulfatul de aluminiu se folosește în industria hârtiei (pentru încleierea hârtiei), în tăbăcărie, în imprimeria textilă, ca mordant, precum și ca materie primă pentru obținerea altor combinații ale aluminiului.
Alaunul sau piatra acră este sulfatul dublu de aluminiu și potasiu, KAl(SO4)2·12H2O. Se prepară prin tratarea argilei uscate cu acid sulfuric și amestecarea soluției concentrate cu sulfat de potasiu. Este o substanță cristalizată în octaedre incolore, solubilă în apă caldă și foarte astringentă. Ca și sulfatul de aluminiu este mult întrebuințat în vopsitorii textile pentru fixat culorile (este un mordant), apoi pentru limpezirea apelor tulburi, tăbăcărie, la fabricarea hârtiei, în medicină etc.
Alaunii sunt o clasă de combinații în compoziția cărora pot intra și alte metale; astfel, ca metal trivalent mai pot funcționa fierul sau cromul, iar ca metal monovalent, rubidiul, cesiul amoniul și taliul. Toți alaunii au formula MIMIII(SO4)2·12H2O și cristalizează în octaedre; ei sunt izomorfi.
Acetatul de aluminiu, Al(CH
3COO)
3, se obține prin tratarea sulfatului de aluminiu cu acetat de plumb sau de bariu sau prin tratarea hidroxidului de aluminiu cu acid acetic. Este o substanță albă care în apă hidrolizează puternic; de aceea din soluție apoasă se separă cu timpul un precipitat de acetat bazic.
Acetatul de aluminiu se folosește mult în imprimeria textilă (ca mordant pentru bumbac) și în medicină (ca antiseptic și dezinfectant).
 H = -402 kcal/mol
H = -402 kcal/mol H = -195 kcal/mol
H = -195 kcal/mol