Atmosfera Pământului, numită simplu aer, este gazul care înconjoară planeta. Compoziția aerului uscat la nivelul mării este: azot 78,08%, oxigen 20,95%, argon 0,93%, dioxid de carbon 0,03%, neon 0,0018%, heliu 0,0005%, kripton 0,0001% și xenon 0,00001%. Pe lângă vapori de apă, în anumite zone, aerul mai conține și compuși ai sulfului, peroxid de hidrogen, hidrocarburi și particule de praf.
Pâna la descoperire oxigenului se presupunea că aerul este o substanță unitară. Abia în 1777 s-a ajuns la concluzia că aeru trebuie să fie un amestec de două gaze: oxigen și azot, gaze denumite astfel de către
Lavoisier, care prin experiența lui istorică - oxidarea mercurului în retortă - a demonstrat că aerul este un amestec alcătuit din 1/5 oxigen și 4/5 azot.
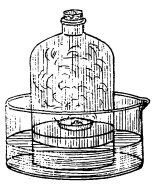
Faptul că aerul este un amestec format din oxigen și azot se mai poate demonstra aprinzând (cu o vergea de sticlă încălzită) o bucățică de fosfor într-o capsulă de porțelan, așezată pe un dop de plută ce plutește pe apă, într-un cristalizator, totul fiind acoperit cu un clopot de sticlă (figura de mai jos).
Arderea fosforului în aer
După ce pentoxidul de fosfor rezultat prin arderea fosforului se dizolvă în apa din cristalizator (formând acidul fosforic), se poate constata că nivelul apei s-a ridicat cu 1/5 din volumul ocupat înainte de aerul din clopot. Introducând o lumânare aprinsă sub clopot, lumânarea se stinge, dovedind prin aceasta prezența numai a azotului.
Componente ale aerului sunt și gazele rare. În aer se mai găsesc de asemenea cantități mici de dioxid de carbon și vapori de apă, în proporții diferite, după localitate. Astfel, aerul din vecinătatea unei ape este mai bogat în vapori de apă, după cum cel de lângă centrele industriale este mai bogat în dioxid de carbon. Tabelul de mai jos prezintă compoziția aerului uscat, la o înălțime nu prea mare de pământ (compoziția aerului variază cu înălțimea):
Compoziția aerului
| Gazul |
% de volum |
% de masă |
| Azot |
78,08 |
75,53 |
| Oxigen |
20,95 |
23,14 |
| Dioxid de carbon |
0,03 |
0,047 |
| Argon |
0,93 |
|
| Neon |
0,0018 |
|
| Heliu |
0,0005 |
|
| Kripton |
0,0001 |
|
| Xenon |
0,00001 |
|
Aerul mai poate conține și cantități variabile de praf, urme de dioxid de sulf și de hidrogen sulfurat, precum și bacterii.
Aerul nu are miros, gust sau culoare. Privit în strat gros, el pare albastru.
Densitatea aerului a fost luată ca unitate pentru densitățile gazelor. Un litru de aer uscat, la 0°C, cântărește 1,293 g.
Presiunea pe care o exercită aerul asupra pământului - presiunea atmosferică - echilibrează o coloană de mercur cu înălțimea de 760 mm.
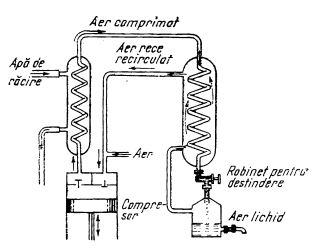
Aerul este rău conducător de căldură și electricitate, mai ales când este uscat. El poate fi lichefiat, prin răcire la o temperatură foarte joasă. Aceasta se realizează pe baza principiului fizic că atunci când un gaz trece de la o presiune mare la o presiune mică, deci când se destinde, el se răcește (slăbirea forțelor de atracție intermoleculară necesită energie). Deoarece dintr-o singură dată nu se ajunge la temperatura destul de scăzută pentru lichefiere, operația se repetă de mai multe ori (figura de mai jos).
Schema lichefierii aerului (după Linde)
Aerul lichid este incolor și transparent; el are densitatea apropiată de a apei. Nefiind o substanță unitară, nu are un punct de fierbere fix. (Separarea oxigenului și azotului din aerul lichid se bazează tocmai pe diferența dintre punctele lor de fierbere.)
Din cauza temperaturii de fierbere foarte joase a componentelor, aerul lichid lăsat descoperit se evaporă violent. Substanțele ținute în aer lichid își schimbă brusc proprietățile. Astfel, frunzele sau florile plantelor, cufundate în aer lichid, devin casante ca și sticla, mercurul se solidifică imediat, plumbul capătă la lovire un sunet clar și metalic, obiectele de cauciuc devin atât de fragile încât lovite ușor se sparg în țăndări etc. Transformările pe care le suferă corpurile cufundate în aerul lichid sunt trecătoare; imediat ce corpurile se încălzesc, ele își redobândesc proprietățile anterioare.
Proprietățile chimice ale aerului sunt cele ale gazelor din care este format. Rolul principal îl are oxigenul, care își păstrează în amestec toate proprietățile lui, moderate în măsura diluării sale cu azot. Rolul secundar îl deține azotul, care este necesar vegetației. În al treilea rând vine dioxidul de carbon, care are și el un rol în nutriția plantelor. Vaporii de apă care se găsesc în aer determină descompunerea materiilor organice, transformându-le în dioxid de carbon, apă și amoniac (proces numit fermentație) etc.
Aerul servește la respirația animalelor și plantelor, datorită oxigenului și dioxidului de carbon pe care le conține. Unele plante și bacterii folosesc chiar și azotul din aer. Aerul are însă și însemnate întrebuințări industriale: el este materia primă a multor ramuri din industria chimică. Astfel, el se folosește în mod curent pentru prepararea oxigenului și a azotului, precum și a gazelor rare, la prepararea unor oxizi precum: miniul (oxidul de plumb), albul de zinc (oxid de zinc) etc. La prăjirea unor minereuri cu sulf, ca, de exemplu, pirita din care se obțin cantități mari de dioxid de sulf, materie primă pentru prepararea acidului sulfuric. În siderurgie și în metalurgia cuprului se folosesc cantități importante de aer. Întreținând arderea, datorită oxigenului pe care îl conține, aerul constituie un factor important la iluminat și încălzit.