Grupa a V-a principală a sistemului periodic, numerotată V A sau 15, cuprinde următoarele elemente:
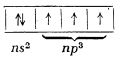
Atomii acestor elemente au stratul electronic exterior format din cinci electroni:
Existența acestor cinci electroni conferă în principiu elementelor numărul de oxidare maxim cinci. În realitate, însă, acest număr maxim se manifestă numai foarte rar. El se întâlnește în unii compuși pentahalogenați. (În compușii halogenați, de tipul X2O5, elementul X este în realitate tetracoordinat.)
Atomii elementelor grupei 15 nu formează în general combinații ionice. În soluție nu se cunosc cationi decât la stibiu, Sb3+, și bismut, Bi3+. În acești cationi, electrovalența maximă nu este atinsă. Doar cei trei electroni p sunt ionizabili și nu au și cei doi electroni s. La aceste elemente mai grele, ionizarea este posibilă datorită ecranizării nucleului de către mai multe straturi electronice.
Fiind așezate mai departe de gazele rare, la elementele acestei grupe atomii nu manifestă, în general, tendință de a forma ioni negativi (repulsia datorată electronilor atomilor este atât de mare, încât nucleul nu poate să mai atragă alți trei electroni necesari completării învelișului electronic exterior). Ionii N3-, P3- și As3- există numai în stare solidă (în unele nitruri, fosfuri sau arseniuri metalice).
Atomii elementelor grupei a V-a principale tind, însă, să-și completeze stratul electronic exterior prin formare de legături covalente.
În mod obișnuit, conform regulii octetului, atomii elementelor grupei a V-a pot forma trei covalențe; compușii respectivi au formula generală XR3. La formarea covalențelor participă cei trei electroni p.
Cum regula octetului se aplică riguros la a doua perioadă mică, azotul poate fi numai tricovalent.
În cazuri speciale, din cauza existenței perechii de electroni neparticipanți s2, atomii elementelor grupei pot forma și combinații în care sunt legați coordinativ, având rol de donori de electroni. Această proprietate este pronunțată la azot. (Omologii azotului pot avea rol și de acceptori de electroni).
Odată cu creșterea volumului atomic crește și valoarea maximă a numărului de coordinație a acestor elemente. Regula octetului, valabilă riguros la azot, limitează numărul de coordinație al acestui element la patru. La fosfor, arsen și uneori la stibiu, numărul maxim de coordinație este cinci, de exemplu în halogenuri (PF5, PCl5, AsF5, SbF5). Stibiul și bismutul formează complecși în care numărul lor de coordinație se ridică chiar la șase, de exemplu în [Sb(OH)6]K și [BiI6]K2.
Proprietățile fizice ale elementelor grupei 15 sunt arătate în tabelul de mai jos:
Caracteristicile elementelor din grupa 15 a sistemului periodic
| Caracteristici |
Azot
N |
Fosfor
P |
Arsen
As |
Stibiu
Sb |
Bismut
Bi |
| Numărul atomic |
7 |
15 |
33 |
51 |
83 |
| Configurația electronică exterioară |
2s22p3 |
3s23p3 |
4s24p3 |
5s25p3 |
6s26p3 |
| Masa atomică |
14,007 |
30,974 |
74,922 |
121,75 |
208,98 |
| Densitatea (s), g/cm3 |
0,96 |
1,82 |
5,72 |
6,69 |
9,80 |
| Punctul de topire, °C |
-210,0 |
44,1 |
817 (36 atm) |
630,5 |
271,0 |
| Punctul de fierbere, °C |
-195,8 |
280 |
633 |
1640 |
1560 |
| Potențialul de ionizare, eV |
14,54 |
11,0 |
10,0 |
8,64 |
8,0 |
Electronegativitatea
(conform L. Pauling) |
3,0 |
2,1 |
2,0 |
1,9 |
1,9 |
| Raza de covalență, Å |
0,74 |
1,10 |
1,21 |
1,41 |
1,52 |
| Raza ionică (pt. X3-), Å |
1,71 |
2,12 |
2,22 |
2,45 |
- |
Omologii azotului au proprietatea de a exista sub formă de mai multe modificații alotropice, dintre care, la arsen, stibiu și bismut, modificația alotropică obișnuită este cea metalică.
Azotul are molecula diatomică; în stare gazoasă, fosforul, arsenul și stibiul au molecula formată din patru atomi; molecula de bismut este diatomică. În stare solidă, fosforul, arsenul și stibiul au atât structură tetraedrică (P4, As4, Sb4), cât și structură metalică; bismutul are numai structură metalică.
Cu hidrogenul, elementele grupei 15 formează combinații de tipul XH3, unde X reprezintă elementul grupei, adică NH3, PH3, AsH3 etc. În timp ce combinațiile cu hidrogenul ale elementelor grupei 17 (hidracizii halogenați) au caracter acid, iar cele din grupa 16, caracter slab acid (ca de exemplu H2S), combinațiile cu hidrogenul ale elementelor grupei 15 nu mai au caracter acid (din această cauză, formulele lor nu se scriu cu hidrogenul înainte, ca la acizi; de exemplu: NH3 și nu H3N; PH3 și nu H3P). NH3 este o bază slabă.
Stabilitatea hidrurilor este din ce în ce mai mică la ultimele elemente ale grupei: amoniacul, NH3, este un compus stabil, pe când hidrura de bismut, BiH3, este atât de instabilă, încât a fost obținută cu greu.
Aceasta reiese, de altfel, din căldurile de formare ale acestor hidruri:
Căldurile de formare ale hidrurilor elementelor din grupa 15
| Hidrura |
NH3 |
PH3 |
AsH3 |
SbH3 |
Căldura de formare, kcal/mol lichid
gaz |
-11
-16,07 |
-6
-2,3 |
43
43,6 |
35
81,8 |
Molecula de NH3 poate adiționa un ion de hidrogen, formând radicalul amoniu, care în soluție formează ionul pozitiv monovalent NH4+. Această manifestare este mai puțin accentuată la PH3, care formează radicalul fosfoniu PH4, și nu se mai întâlnește la celelalte elemente. În aceste combinații, numărul de coordinație al azotului și fosforului este patru.
Cu oxigenul, elementele grupei 15 formează combinații de tipul X2O3 și X2O5, care sunt anhidride. Astfel, N2O3 este anhidrida azotoasă și N2O5 - anhidrida azotică; P2O3 - anhidrida fosforoasă și P2O5 - anhidrida fosforică etc.
Acizii corespunzători sunt de tipul HXO2 și HXO3 (de exemplu HNO2 și HNO3):
X2O3 + H2O → 2HXO2
X2O5 + H2O → 2HXO3
sau de tipul H3XO3 și H3XO4 (de exemplu H3AsO3 și H3AsO4):
X2O3 + 3H2O → 2H3XO3
X2O5 + 3H2O → 2H3XO4
Tăria acizilor în care elementul are număr de oxidare cinci se micșorează odată cu creșterea numărului atomic al elementului. Deci scade tăria acizilor în ordinea:
HNO3 H3PO4 H3AsO4 H[Sb(OH)6] Bi2O5 · H2O(?)
acid azotic acid fosforic acid arsenic acid antimonic acid bismutic (?)
Astfel, acidul azotic este un acid tare, acidul fosforic un acid de tărie mijlocie, iar acidul arsenic și acidul antimonic sunt acizi slabi (cunoscuți numai în soluție sau ca săruri). Compoziția acidului bismutic nu este cunoscută (există însă săruri care derivă de la acest acid).
Cu creșterea numărului atomic crește și caracterul electropozitiv al elementelor grupei 15. Astfel N2O3 și P2O3 sunt anhidride acide, pe când As2O3 și Sb2O3 au caracter amfoter, iar Bi2O3 este un oxid cu caracter bazic pronunțat.
Intensificarea caracterului electropozitiv se manifestă și în ce privește acțiunea apei asupra derivaților halogenați. De exemplu, triclorura de fosfor este total hidrolizată în acid fosforos și acid clorhidric:
PCl3 + 3H2O → H3PO3 + 3HCl
Triclorura de arsen, AsCl3, este parțial hidrolizată datorită reacției în sens contrar (hidroxidul de arsen rezultat are caracter amfoter). Hidroliza triclorurii de stibiu, SbCl3, și a triclorurii de bismut, BiCl3, se oprește la o etapă intermediară, cu formarea unor săruri ale oxidului de stibiu sau de bismut, [SbO]+ sau [BiO]+, în soluție rămânând o cantitate de ioni Sb3+ și Bi3+.
Unele elemente ale grupei pot manifesta și alte grade de oxidare față de oxigen; astfel, azotul formează combinații cu oxigenul în care are numerele de oxidare de la +1 la +5.
Ca și la elementele altor grupe principale ale tabelului periodic, primul element (azotul) și ultimul element (bismutul) din grupă manifestă proprietăți oarecum diferite de fosfor, arsen și stibiu. Astfel, azotul este mai puțin reactiv, derivații lui trihalogenați sunt instabili, nu poate forma derivați pentahalogenați etc.