Compuși de gaze rare
Tag-uri
Partajeaza in Google Classroom
Scurtă definiție
Definiție Descarcă PDF
Configurația moleculelor compușilor de gaze rare
Formarea legăturilor în compușii de gaze rare
Compușii de gaze rare sau compușii gazelor nobile sunt compuși chimici care au în molecula lor un element din grupa 18 (VIII A) a tabelului periodic, grupa gazelor rare. Mult timp, elementele grupei 18 au fost considerate nereactive, însă în ultimele decenii s-au descoperit mai mulți compuși, în special compuși ai elementului xenon.
Compuși de gaze rare
După descoperirea primului compus chimic al unui gaz nobil, în 1962, diferite grupe de cercetători au preparat și alți compuși de gaze rare, ca de exemplu fluorurile de xenon. Astfel, prin sinteza directă între xenon și fluor, la 400°C, sau prin iradierea cu lumină ultravioletă a unui amestec de xenon și fluor, s-a obținut bifluorura de xenon, XeF2, substanță cristalină, incoloră, cu punct de topire la 140°C.
Prin încălzirea unui amestec de xenon și fluor sub presiune în autoclavă de nichel, la 400°C, se obține tetrafluorura de xenon, XeF4, cristale incolore care se topesc la 114°C.
Hexafluorura de xenon, XeF6, prima combinație a xenonului hexavalent care a fost preparată, se poate obține prin încălzirea unui amestec de xenon și fluor în mare exces, la presiune și temperatură înalte (250-500°C) și apoi răcire la -78°C.
S-au mai preparat și octafluorura de xenon, XeF8, oxifluoruri de xenon, ca XeOF4, oxizi de xenon ca XeO3, XeO4, etc.
De asemenea, au fost obținute combinații ale kriptonului și radonului, ca de exemplu tetrafluorura de kripton, KrF4, acidul kriptic, KrO3 • xH2O, kriptatul de bariu, BaKrO4, fluorura de radon, RnFx, etc.
Odată cu realizarea sintezei compușilor gazelor nobile, s-au efectuat studii asupra structurii compușilor obținuți și s-au emis ipoteze cu privire la modul de formare a legăturilor între atomii de gaz rar și atomii altor elemente cu care aceștia s-au legat.
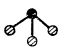
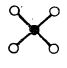
Configurația moleculelor compușilor de gaze rare a fost determinată pe cale experimentală (prin analize spectrale sau de difracție electronică). Așa s-a stabilit, de exemplu, că molecula de bifluorură de xenon are o configurație liniară, atomul de xenon fiind așezat la o distanță de circa 2 Å de cei doi atomi de fluor; tetrafluorura de xenon are o configurație plan-pătrată, atomul de xenon, fiind situat la 1,92 Å față de cei patru atomi de fluor care îl înconjoară.
| Compusul | XeF2 | XeF4 | XeOF4 | XeO4 | XeO3 | XeO64- |
|---|---|---|---|---|---|---|
| Configurația |  |
 |
 |
 |
 |
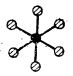 |
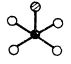
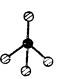
| Forma | liniară | plan-pătrată | piramidală cu baza pătrată |
piramidă tetragonală | piramidă trigonală | octaedrică |
Formarea legăturilor în compușii de gaze rare
Din studiile teoretice efectuate s-au desprins două ipoteze cu privire la posibilitatea formării legăturilor în compușii de gaze rare.
După prima ipoteză, se consideră că octetul electronic exterior al atomului de gaz nobil este depășit. De exemplu, tetrafluorura de xenon, XeF4, se formează prin participarea a 12 electroni în legături chimice: octetul exterior al atomului de xenon dă opt electroni și fiecare atom de fluor dă câte un electron. Acești 12 electroni formează șase perechi de electroni, care sunt orientați octaedric în jurul atomului de xenon. Prin urmare, este necesar să mai fie implicați și doi orbitali d ai xenonului, proveniți din tranzițiile p → d și s → d. Hibridizarea este deci sp3d2. Două dintre aceste perechi de electroni ocupă vârfurile opuse ale unui octaedru imaginar, sub formă de perechi de electroni neparticipanți, iar celelalte patru perechi, care se găsesc în același plan, formează legături cu cei patru atomi de fluor. În modul acesta, toți cei cinci atomi componenți ai moleculei se găsesc în același plan; deci pentru combinația XeF4 rezultă o așezare plan-pătrată, așa cum a fost determinată și pe cale experimentală. Lungimea legăturii a fost calculată la 1,97 Å, ceea ce este în bună concordanță cu valoarea 1,93 Å stabilită experimental.
La formarea bifluorurii de xenon, XeF2, legăturile moleculare includ zece electroni: opt electroni provin de la atomul de xenon și doi electroni de la cei doi atomi de fluor. Se formează deci cinci perechi de electroni. Același raționament folosit pentru explicarea structurii la tetrafluorura de xenon arată în cazul bifluorurii de xenon o hibridizare sp3d. Aceasta condiționează o bipiramidă trigonală imaginară ale cărei vârfuri sunt ocupate de atomii de fluor, în timp ce în cele trei colțuri ale bazei se găsesc trei perechi de electroni neparticipanți. Ca urmare a așezării atomilor componenți, molecula XeF2 ar trebui să aibă o structură liniară, ceea ce corespunde de asemenea cu rezultatele experimentale.
Însă, conform acestei ipoteze a octetului depășit nu se poate explica bine formarea hexafluorurii de xenon, XeF6, deoarece, în acest caz, în jurul atomului de xenon ar trebui să se găsească 14 electroni de legătură. Aceasta corespunde unei hibridizări sp3d3, care este puțin stabilă. În schimb, această ipoteză poate explica bine structurile oxifluorurilor de xenon, XeF4O și XeF4O2.
A doua ipoteză privind structura orbitalilor moleculari a fluorurilor de xenon este complet diferită și neobișnuită. Conform acestei ipoteze, structura atribuită orbitalilor moleculari este alcătuită din legături liniare F - Xe - F, formate prin întrepătrunderea a doi orbitali 2p (ocupați fiecare cu câte un electron) din stratul electronic exterior al atomilor de fluor cu un orbital 5p (ocupat cu doi electroni) din stratul electronic exterior al atomului de xenon. În modul acesta, patru electroni de valență se repartizează în orbitalii moleculari formați prin combinarea liniară a celor trei orbitali atomici p.
După această structură propusă, atomul de xenon își păstrează octetul exterior, adică regula octetului este respectată. Perechile liniare F - Xe - F apar o dată în XeF2, de două ori în XeF4 și de trei ori în XeF6.
Și în favoarea acestei ipoteze sunt o serie de date experimentale; de exemplu, lungimea legăturii Xe - F, calculată după această ipoteză, corespunde cu rezultatele experimentale.
Preambul
Referințe
2. James E. House: Inorganic Chemistry, Academic Press, Elsevier, 2008, ISBN 9780123567864






