Atomul
Tag-uri
Partajeaza in Google Classroom
Transcript
Salut eu sunt Carmen și împreună
vom descoperi cât de importantă
este chimia și că fiecare dintre
noi ar trebui să aibă câteva cunoștințe
de chimie pentru a ne proteja pe
noi pe cei dragi nouă dar și mediul
înconjurător vom vedea și că de
fapt eu știință chiar fascinantă
dacă nu sunteți așa convingi vedeți
voi că această știință Răspunde
la întrebări precum Din ce e făcută
materia sau De ce un stick de memorie
care ne încap în buzunar poate
avea mai mulți giga de memorie
decât două laptopuri tot chimia
e cea care ia făcut posibile geamurile
care se spală singure adică sticla
cu autocurățare sau blugii care
nu se prezinți odată și tot chimia
e știința care va ajuta la dezvoltarea
mașinilor zburătoare sau la Găsirea
unei soluții pentru încălzirea
globală Deci chimia știință care
se ocupă cu studiul ea tot ceea
ce ne înconjoară adică a materiei
și a transformărilor pe care materiale
suferă materia e compusă din substanțe
cu structuri complexe care conțin
molecule Ioni sau atomi substanțele
pot fi substanțe simple sau substanțe
compuse si simple conțin molecule
formate din atomi identici Spre
exemplu o molecula de oxigen Care
E formată din doi atomi de oxigen
iar substanțele compuse din molecule
formate din atomi diferiți Spre
exemplu în molecula de apă care
conține un atom de oxigen și doi
atomi de hidrogen pentru a intrat
mai în profunzime cu studiul chimiei
vom începe cu probabil cea mai
importantă idee a tuturor timpurilor
și anume aceea Că materia E formată
din atom ideea asta există încă
din antichitate când filozofi greci
sau ce se întâmplă dacă tot taie
o bucată de ceva orice în bucăți
tot mai mici sau gândi filozofică
de și Ei na un cuțit atât de ascuțit
încât să reușească asta totuși
intru în final se va ajunge la
o particulă indivizibilă particulă
care nu mai poate fi tăiată ca
să zicem așa în alte particule
în limba greacă Termenul pentru
om indivizibil este atom Deci așa
a apărut noțiunea că atomul este
cea mai mică particulă posibilă
care încă mai păstrează proprietățile
unei substanțe simple fiind ceea
ce face ca o substanță să fie diferită
de alte substanțe mult mai târziu
odată cu evoluția Științei sa descoperi
ca Tomi conțin și ei la rândul
lor alte particule Deci atomii
au proprietăți fizice și chimice
specifice în funcție de numărul
și aranjamentul A3 particule Saab
particulele subatomice se mai numesc
și particule elementare și sunt
următoarele electronii simboliza
ți prin A minus a o sarcină electrică
negativă și sunt cele mai puțin
grele dintre particulele subatomice
protonii au sarcina electrică pozitivă
de simbolul lor este pe plus Ciao
ma sub de aproape două mii de ori
mai mare decât a electronilor de
fapt sunt tot Foarte ușori dar
față de electroni sunt mult mai
grei neutronii simbolizat prin
m0 nu au sarcină electrică și la
fel ca protonii o masă de aproape
două mii de ori mai mare decât
electroni protoni și neutroni formează
regiunea centrală a atomului Adică
nucleul care este parte dance și
greu Deci protoni și neutroni se
mai numesc și nucleon pe lângă
nucleu atomul are în structura
sa și un înveliș electronic învelișul
electronic este constituit de dintre
o zonă difuză foarte largă În jurul
nucleului în care se învârte electronii
Deci un atom arată cum așa nucleul
foarte mic și dans cu protoni și
neutroni în centru și învelișul
electronic în jurul nucleului zona
difuză pe unde se învârte electronii
despre reprezentarea învelișului
electronic vom vorbi mai multe
între o lecție viitoare pe scurt
structura unui atom este următoarea
atomului e format din un nucleu
Unde se află protonii si neutronii
și dintre un înveliș electronic
Unde se găsesc electronii Haideți
să analizăm mă câteva din caracteristicele
a particulelor subatomice reprezentate
în acest tabel din tabel se observă
că protoni și neutroni iau masei
aproape egal de ordinul 10 la minus
27 kg care corespund la aproximativ
o unitate atomică de masă notată
cu u sau unele cazuri cu ua ce
consideră că electronul nu are
masă întrucât greutatea lui e de
ordinul 10 la minus 31 kg adică
în unități atomice de masă ar veni
0 540 constatăm că masa atomului
e concentrată în nucleu ia Fiind
dată de protoni și de neutron în
tabel mai sunt reprezentate simbolurile
particulelor subatomice și sarcina
lor electrică un atom este extraordinar
de mic dar nucleul deși a chiuli
concentrată greutate atomului este
din mii de ori mai mic decât atomul
ca întreg numai că un protoni din
nucleu este de 100.000 de ori mai
mic decât un atom dacă ne gândim
la un atomică a fiind de dimensiunea
unui stadion de fotbal atunci un
prost de dimensiunea unei muște
în centru Stadionului am văzut
Deci Că toți atomi sunt formați
din trei tipuri de particule subatomice
Dar ce face ca un atom să fie diferit
de aicea Tom și astfel ca o substanță
să fie diferită de alte substanță
și tot așa e bine răspunsuri stă
în numărul de protoni una Tom se
Identifică prin numărul de protoni
din nucleul său acesta se notează
cu Z și se numește număr atomic
pentru a putea continua trebuie
să vedem și Ce este un element
e nimic Iar pentru asta vom discuta
puțin despre sarcină electrică
a atomului în ansamblul său un
atom este neutru să vedem și de
ce pornind de la nucleu știm că
neutroni iau sarcină 0 iar protonii
au sarcină pozitivă adică plus
Deci sarcina nucleară Dar fii pozitivă
și egală cu numărul de protoni
din nucleu Deci cu numărul Atomic
z sarcina nucleară se va nota cu
plus z mai departe în învelișul
electronic ăla Toma are un număr
de electroni egal cu numărul de
protoni din nucleu astfel sarcina
negativă din învelișul electronic
anulează sarcină pozitivă a nucleului
arată omul rămâne neutru aceea
Tom care au același număr atomic
Și de ce aceeași sarcina nucleară
plus D formează un element chimic
în funcție de număr atomic z elementele
au fost aranjate în tabelul periodic
al lui mendel astfel 10 sute și
numărul de ordine ale elementelor
vor relua acum toate semnificațiile
numărului atomic z și numărul atomic
de reprezintă numărul de protoni
din nucleu numărul de electroni
din învelișul electronic numărul
de ordine ale elementelor chimice
în tabelul periodic și sarcina
nucleară plus z trebuie să reținem
că aceste semnificații sunt valabile
în cazul atomilor neutri când vom
discuta despre Ion veți vedea că
numărul de protoni nu este întotdeauna
egal cu numărul de electroni din
învelișul electronic am văzut Deci
că un element chimic este caracterizat
prin numărul atomic Z Dar nu numai
elementele chimice sunt caracterizate
și prin numărul de masă care se
notează cu a după cum am discutat
mai devreme masa unui atom e concentrată
în nucleu deoarece un Proton are
aproximativă o unitate atomică
de masă neutronul are la fel aproximativă
unitatea de masă iar electronii
au aproximativ 0 unități atomice
de masă astfel suma dintre numărul
de protoni și numărul de neutroni
se numește număr de masă deci a
numărul de masă este egal cu Z
numărul Atomic plus n unde n este
numărul de neutroni deci știm acum
că mărimile care caracterizează
un element chimic sunt numărul
Atomic și numărul de masă a ele
se scriu în fața simbolului elementului
chimică în acest fel e fiind simbolul
elementului a partea de sus și
z jos de exemplu simbolul elementului
carbon este si cu numărul atomic
Z egal cu 6 și numărul de masă
egal cu 12 din această reprezentare
elementului chimic ne dăm seama
că carbonul are 6 electroni în
învelișul electronic 6 protoni
în nucleu și 12 minus 6 6 neutroni
iar simbolul elementului clor este
acesta 17 fiind numărul Atomic
10:35 numărul de masă A deci știind
că clorul are 17 electroni în învelișul
electronic 17 protoni în nucleu
iar pentru a afla numărul neutronilor
facem diferența dintre numărul
de masă a și numărul Atomic z Deci
clorul are 18 neutroni ce e foarte
important de reținut e că elementul
cu numărul atomic Z egal cu 17
va fi întotdeauna clorul și că
elementul cu numărul atomic z este
egal cu 6 deci cu șase protoni
în nucleu va fi întotdeauna carbonul
dacă avem un atom cu șapte protoni
în nucleu e vorba de j de azot
Deci azotul este singurul element
chimic existent care va avea șapte
protoni în nu leu Așadar numărul
de protoni determină identitatea
elementului Bun deci cheme acum
că atomul e particula cea mai mică
care mai păstrează caracteristicile
unei substanțe Cică piai știința
celor trei particule subatomice
foarte foarte mici protonul neutronul
și electronul care se uită milioane
și milioane de combinații formând
elementele chimice și substanțele
și materia adică tot ceea ce ne
înconjoară am văzut lecția aceasta
și cât de important sunt protonii
iar în lecția viitoare vom da mai
multă atenție neutronilor și vom
vorbi despre izotopi și masa atomică

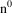

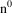

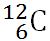 . Astfel deducem că atomul de carbon are următoarele particule subatomice:
. Astfel deducem că atomul de carbon are următoarele particule subatomice:




