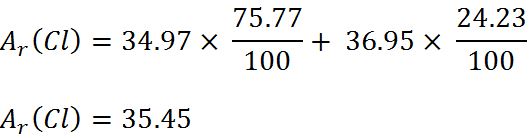Masă atomică. Izotopi. Mol de atomi
Partajeaza in Google Classroom
Transcript
am văzut data trecută că un atom
e format dintr un nucleu Unde se
găsesc protonii si neutronii și
să intru în învelișul electronic
Unde se găsește electronii nucleul
atomului prin numărul de protoni
pe care îi conține este caracteristica
definitorie a elementelor chimice
numărul de protoni oferind identitate
a fiecărui atom în parte este un
număr extrem de stabil Care este
neatenți din reacțiile chimice
electroni în schimb pot sări de
la un atom la altul lor când e
nevoie de asta pentru ca reacțiile
chimice să aibă loc deci electronii
sunt cu mult mai interesanți decât
particulele din nucleul neutronii
sunt și ei importanți în felul
lor de exemplu numărul lor nu schimbă
identitatea unui atom unul dintre
cele mai importante lucruri care
definesc un alt 1000 sarcină electrică
iar neutronii nu au sarcină deci
nu prea contează proprietățile
atomii dar încă sarcinile identice
se resping între ele imaginații
vă un nucleu fără neutron acesta
nu a rezistat de fapt protoni sar
respinge mult prea puternic exemplu
în cazul carbonului cei șase protoni
din nucleu nu sta împreună o așa
cuminți dacă nu ar fi neutroni
care se tempereze reacțiile de
respingere dintre protonii care
au cu toții sarcină pozitivă Deci
carbonul are nevoie de 6 ori care
să țină împreună în nucleu si 6
protopic se întâmplă un lucru foarte
interesant cei sase protoni pot
fi ținuți împreună și de 7 neutroni
sau de 8 de 8 RON deci există trei
tipuri de carbon stabil în natură
cu acest număr atomic Z egal 6
dar cu număr de neutroni diferit
pentru că numărul de neutroni diferit
rezultă și numărul de masă a este
diferit Așadar cele trei tipuri
de carbon sunt carbon 12 care are
șase protoni și șase neutroni în
nucleu și 6 electroni în învelișul
electronic carbon 13 Acesta are
6 protoni și 7 neutroni în nucleu
și 6 electroni și carbon 14 care
are 6 protoni și 8 neutroni în
nucleu și tot 6 electroni în învelișul
specii de atomi cu același număr
Atomic z dar cu număr de masă a
diferit se numesc izotopi după
cum am văzut un izotop se notează
cu aceleași simbol ca și elementul
Cetatea elementelor se găsesc în
natură ca amestecuri de izotopi
din cele 92 de elemente naturale
cunoscute 69 sunt amestecuri de
izotopi stabili de exemplu și uraniul
care e un element radioactiv Și
are numărul Atomic Z egal cu 92
se găsește în natură ca un amestec
de trei izotopi și anume uraniu
234 care are în nucleul său 142
de neutroni și 92 de protoni uraniu-235
care conține nucleu 143 de neutroni
și 92 de protoni și uraniu-238
care conține nucleu 146 de neutroni
și 92 de protoni pentru a putea
continua discuția despre izotopi
și masele lor atomice va trebui
să vedem mai întâi Cum se măsoară
masa unui atom în general Casa
unui atom este foarte foarte mică
în raport cu unitatea de măsură
utilizată în sistemul internațional
adică în raport cu kilogramul de
aceea mase atomii lor se exprima
sub formă de multiplii ai unității
atomice de masă o unitate atomică
de masă care se notează prin USA
o am după cum am spus și lecția
trecută este egală prin convenție
cu 12-a parte din masa unui atom
al izotopului de carbon 12 unitatea
atomică de masă ar fi egală cu
0 66 ori 10 la minus 26 de kg Deci
numărul ăsta arată Cam așa 0 166
și aici ar trebui să fie 26 de
zerouri Așa că mai bine folosim
unitățile atomice de masă ca să
nu Ne încurcăm în atâtea zerouri
și virgule și astfel masa atomică
relativă sau masa atomică reprezintă
numărul care arată de câte ori
masa unui atom e mai mare decât
unitatea atomică de masă Adică
De câte ori masa unui atom este
mai mare decât a 12-a parte din
masa unui atom de carbon 12 Bun
deci acum putem reveni la izodom
am văzut în cazul izotopilor că
numărul Atomic z nu se schimbă
dar se schimbă masa atomică relativă
și a astfel masa atomică a unui
element care se găsește în natură
sub forma a mai multe izotopi stabili
este dependentă de masa atomică
relativă a izotopilor pe care o
Vom nota cu A1 pentru izotopul
cu numărul unu și cu ei doi pentru
izotopul cu numărul 2 și tot așa
în funcție de cât izotopi are elementul
deci a 1 a 2-a n iar masa atomică
a unui element mai este dependentă
și de procentul sau Denta izotopilor
În compoziția elementului în natură
procentele le vom nota cu a 1%
a 2% și până la Ane la această
masa atomică se numește masa atomică
relativă medie 500 masa atomică
trecută în tabelul periodic în
dreptul fiecărui element dacă vă
veți uita în tabel veți observa
că majoritatea maselor atomice
sunt numere raționale numere cu
virgulă de exemplu în cazul clorului
masa atomică este 35 virgulă 45
să vedem cum să ajung la această
valoare clorul se găsește în natură
sub forma a doi izotopi stabili
și anume clor 35 și clor 37 izotopul
de clor 35 are în nucleu 17 protoni
și 18 neutroni și iar în învelișul
electronic are 17 electroni izotopul
de clor 37 are în nucleul său 17
protoni și 20 de neutroni iar în
învelișul electronic are 17 electroni
în tabel sunt reprezentate masele
izotopilor de clor în unități atomice
de masă și compoziția procentuală
a celor doi izotopi ai clorului
în natură vedem că în cazul izotopului
de clor 35 masă este de 34 și 7
iar procentul este de 75 virgulă
77 în cazul izotopului de clor
37 masă este 36 zeci și 5 unități
atomice de masă iar procentul cu
care se găsește în natură este
24 această compoziție procentuală
reprezintă numărul relativ al atomilor
izotopilor vedem că procentul izotopului
de clor 37 este mai mic este 24
Ana că în 10.000 de atomi ai izotopilor
de clor numărul de atomi de clor
37 este de 2420 și 3 iar numărul
izotopilor de clor 35 este 7577
masa atomică relativă medie a unui
amestec de izotopi se calculează
cu această relație masa atomică
relativă fii notată cu aer de ce
masa atomică relativă a clorului
va fi egală cu masa atomică a izotopului
de clor 35 înmulțit cu procentul
acestui izotopi supra 100 plus
masa izotopului de clor 37 înmulțit
cu procentul acestui izotopi la
100 astfel obține masa atomică
relativă medie a clorului Care
este 35 virgulă 45 Așadar izotopii
diferiți ai unui element au mase
diferite dar au același număr de
protoni în nucleu adică același
număr Atomic z Deci au aceleași
proprietăți chimice și sunt aceleași
elemente și astfel aparțin în același
loc din tabelul periodic de fapt
cuvântul izotop înseamnă același
loc o să trebuie să fim atenți
să nu confundăm numărul de masă
a cu masa atomică despre care tocmai
am vorbit numărul de masă a este
întotdeauna un număr întreg este
simplă adunare dintre numărul de
protoni și numărul de neutroni
pentru un atom și astfel nu este
în niciun caz o medie a maselor
atomice a tuturor izotopilor unui
element Dar există și exprimare
a maselor atomice pentru o unitate
de măsură cu care Noi suntem mai
obișnuit și anume în grame masă
atomică a oricărui aliment exprimată
în grame se numește Mol de atom
putem privi mallul puțin altfel
când te miști iau de afaceri cu
atomi și molecule eu nevoie de
o unitate de măsură ușor de folosit
care se ia considerare dimensiunile
foarte foarte mici alea Tomi lor
și ale moleculelor și să facă trecerea
între aceste dimensiuni foarte
mici și lumea vizibilă pe care
noi o putem înțelege și această
unitate de măsură este molul un
mol de atomi reprezintă cantitatea
în grame dintre o substanță simplă
care conține 6 la puterea 23 acest
număr se numește numărul lui avogadro
și este notat cu n a numărului
a Da este numărul de atomi conținut
în exact 12 g de carbon 12 numărul
de atomi conținuți în 12 g de carbon
ar fi de fapt acesta Deci vedem
că este un număr foarte foarte
mare așa că eu personal prefer
să îl notezi cu n a adică numărul
lui avogadro Deci masa atomică
a oricărui element exprimată în
grame se numește moli de atomi
uneori se folosește și termenul
de atomi gram după denumirea veche
în loc de termenul de moli de atomi
un exemplu masa de una tangram
sau un mol de atomi de neon reprezintă
cantitatea de neon care conține
6 ori 10 la puterea 23 adică numărul
lui avogadro atom de neon și are
valoarea de 2018 Cum calculezi
Se consideră de obicei valoarea
rotunjită a masei atomice cantitatea
de 20 de g de neon corespunde Deci
unui Mol de atomi de neon sau masă
de una tangram de oxigen reprezintă
cantitatea de oxigen care conține
6 de la puterea 23 atomi de oxigen
și are valoarea de 15 g și în calcul
le vom lua în considerare valoarea
de 16 Așadar știm acum mai multe
despre protoni și neutroni și despre
ce înseamnă aceștia pentru un atom
Dar pentru că electroni și ceea
ce fac ei este mult mai interesant
în următoarele lecții va fi vorba
despre învelișul electronic al
unui atom și despre configurațiile
electronice

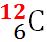 ,
, 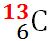 şi
şi 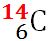 . Tabelul de mai jos prezintă numărul de particule subatomice pentru cei trei izotopi ai carbonului.
. Tabelul de mai jos prezintă numărul de particule subatomice pentru cei trei izotopi ai carbonului. 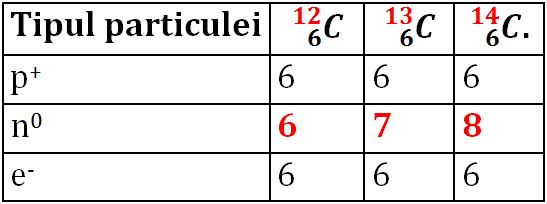
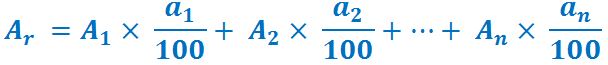
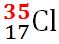 şi
şi 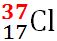 .
.