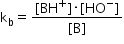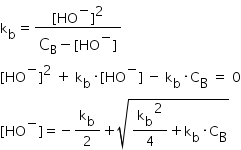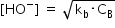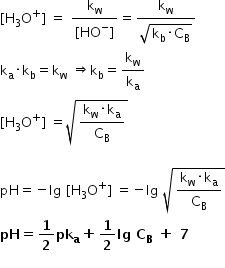pH-ul soluțiilor apoase de baze slabe
Tag-uri
Partajeaza in Google Classroom

Transcript
în continuare vom vedea cum putem
calcula pe hl soluțiilor de baze
slabe bazele slabe tot conțin ionul
hidroxil în structura lor însă
la dizolvarea în apă a acestei
substanțe măresc concentrația de
Ion roxel din apă prin acceptarea
unui Proton de la o moleculă de
apă și formând astfel Union hidroxil
Constanta de bazicitate care caracterizează
acest echilibru are această expresie
consideră concentrația inițială
a bazei ca fiind CD moli pe litru
și aplicăm aceleași simplificări
ca și în cazul acizilor snarry
la echilibru concentrația molară
a ionilor hidroxil este egală cu
concentrația molară a ionilor b
h plus pentru fiecare Ioan hidroxi
format se formează și Union b h
Plus și mai Considerăm că la echilibru
concentrația bazei este egală cu
o concentrație inițială a bazei
minus concentrația ionilor hidroxil
astfel expresia constantei de bazicitate
a se transformă urmează aceeași
serie de calcule ca și în cazul
acizilor slabi pentru a afla concentrația
ionilor oxal Scrie expresii acostandei
de bazicitate sub forma acestei
relații și ajungem în final la
o relație de calcul pentru concentrația
ionilor hidroxid de această formă
relație valabilă pentru bazele
slabe care totuși au în grade disociere
despre de mare pentru bazele cu
Constanța de bazicitate mai mică
decât 10 la minus 5 neglijăm acești
doi termeni astfel că obținem această
formulă pentru calculul concentrației
ionilor hidroxil din soluție sau
la fel cum a făcut și în cazul
acizilor slabi presupunem că la
echilibru bază slabă disociază
atât de puțin încât nici nu are
loc să luăm în considerare că ar
fi modificat concentrația inițială
a bazei cu alte cuvinte aplicat
Malta simplificare și anume concentrația
bazei la echilibru este egală cu
concentrația inițială a bazei astfel
Constanta de bazicitate va avea
această expresie și Aplicând această
simplificare am ajuns una două
dar această relație să nu uităm
că de fiecare dată în cadrul unei
probleme de calcul trebuie să specificăm
simplificările pe care le am aplicat
bandă și acum Avem concentrația
ionilor hidroxil și trebuie aflăm
și concentrația ionilor hidroniu
pentru a putea calcula ph soluției
în această relație înlocuind concentrația
ionilor hidroxil știm și că am
Constanța de aciditate înmulțită
cu Constanța de bazicitate a unui
cuplu acid baza conjugat este egal
cu produsul ionic al apei de un
de Constanța de bazicitate este
egală cu acestora port pe care
înlocuim în această relație de
mai sus și după câteva calcule
obținem relația pentru concentrația
ionilor hidroniu din soluția de
bază slabă astfel de ajun soluției
de bază slabă este egal cu logaritm
zecimal negativ din acest radical
calcule matematice ajungem la această
formulă formulă valabilă pentru
soluțiile de bază slaba Constanța
de bazicitate mai mică decât 10
la minus 5 la temperatura de 25
de grade Celsius în continuare
Nu mă plecați la ce am învățat
pentru a calcula pe hl unei soluții
de amoniac 0 melar nici de Constanța
de aciditate a ionului amoniu ionul
amoniu fim baza conjugată amoniacului
Deci trebuie să aflăm pe hazul
acestei soluții mai întâi scrie
ecuația reacției de ionizare a
amoniacului în apă se formează
ionul amoniu și ionul Oxid echilibrul
este caracterizat prin această
constantă de bazicitate amoniacul
este o bază slabă care disociază
foarte puțin în apă de aceea Considerăm
că la echilibru concentrația amoniacului
este egală cu concentrația inițială
adică cu 0 moli pe litru valoare
pe care o mai putem scrie și sub
forma a 10 la minus 2 moli pe litru
și să mai consideră că la echilibru
concentrația molară a ionilor amoniu
este egală cu concentrația molară
A ionilor hidroxil deci pentru
fiecare ionese Roxy formează și
Ioan Enoiu și se Ignoră Ioni răul
Formați prin auto ionizarea apei
care oricum sunt cu mult mai puțin
față de Ion Mihai draxin Formați
prin ionizare A amoniacului deci
avem aceste două aproximații astfel
expresii a constantei de bazicitate
se transformă iar concentrația
ionilor hidroxid este egală cu
radical din Constanța de bazicitate
ori concentrația inițială a bazei
Constanța de bazicitate aflăm din
relația aceasta înlocuim cu valoarea
constantei de aciditate și obținem
valoarea constantei de bazicitate
1 ori 10 la minus cinci moli pe
litru acum Putem afla concentrația
molară ionilor hidroxil efectuând
calculul și obținem 4 ori 10 la
minus 4 moli pe litru pentru a
afla pe Hagi aceste soluții trebuie
să calculăm și concentrația ionilor
hidroniu Care este egală cu raportul
dintre produsul ionic al apei și
concentrația ionilor hidroxil este
egală cu zece minus 14 supra 4 ori
10 la minus 4 efectuând calculul
și obținem 2 ori 10 la minus 11
moli pe litru de pe hazul este
egal cu minus logaritm zecimal
din 2 ori 10 la minus 11 este egal
cu 11 minus logaritm zecimal din
2 și este egal cu 10 m afla pe H
la aceste soluții și folosind un
de relația pe H plus pe o h egal
cu 14 calculăm pe orașul minus
logaritm din 4 ori 10 la minus 4
efectuând calculul 4 minus logaritm
din 4 22 și obținem pe orașul egal
cu 3 iar pe hazul din această relație
este egal cu 14 minus pe o h adică
este egal cu 14 minus 3 și obținem
astfel tot o valoare de 10 Haideți
să verificăm un rezultatul obținut
și cu formula pe hazlii pentru
baze slabe pentru aplicația asta
formulă trebuie să calculăm exponentul
de aciditate pe ca a este egal
cu minus logaritm din valoarea
constantei de aciditate 0 ore 10
la minus 9 și este egal cu 9 minus
logaritm din 0 efectuând calculul
și am obținut nouă virgulă 25 Așadar
pe hl este egal cu 1 supra 2 ori
9 plus 1 supra 2 ori logaritm zecimal
din concentrația inițială a bazei
adică 10 la minus 2 și plus 7 efectuăm
acest calcul și obținem tot un
ph egal cu

 BH+(aq) + HO-(aq)
BH+(aq) + HO-(aq)