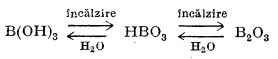Răspândire în natură. Borul se găsește în natură numai sub formă de combinații cu oxigenul: acid boric, borați, precum și în unii silicați. Combinații ale borului se găsesc în cantități foarte mici în fructe și în multe plante agricole (bumbac, sfeclă de zahăr, tutun etc.). El poate fi considerat ca un hormon anorganic al plantelor (în lipsa lui multe plante se ofilesc).
Preparare. Borul se obține prin reducerea anhidridei borice cu magneziu sau sodiu (nu însă cu cărbune, deoarece în acest caz s-ar obține o carbură):
B2O3 + 3Mg = 2B + 3MgO
Borul obținut astfel, denumit și bor amorf, se prezintă sub formă de pulbere brună impură.
Borul perfect pur se obține prin trecerea unui amestec de vapori de tribromură de bor, BBr3, și hidrogen, peste un filament de tantal (sau wolfram):
BBr3 + 3/2 H2 = B + 3HBr
La presiuni scăzute de BBr3 și temperaturi de 1300 - 1500°C ale filamentului, borul condensează pe filament sub formă de cristale macroscopice.
Proprietăți. Borul se aseamănă, prin proprietățile lui fizice, cu primele elemente ale grupei a IV-a principale: carbonul și siliciul.
Se cunosc mai multe forme polimorfe ale borului. În stare pură se prezintă sub formă de cristale negre, foarte dure (are duritatea 9,3), astfel încât zgârie toate corpurile, în afară de diamant. Are un punct de topire foarte înalt.
Ca și în cazul carbonului, conductibilitatea electrică a borului, care este foarte mică la temperatură ordinară, crește odată cu temperatura (cam de 100 ori la o creștere a temperaturii de la 20 la 600°C.) Datorită acestui fapt, borul este folosit la aparate foarte sensibile pentru măsurarea temperaturilor, prin metode electrice.
Borul în stare fin divizată este foarte reactiv, deosebindu-se de inerția chimică pe care o manifestă în stare cristalină compactă. Încălzit la aer la 700°C, borul arde cu flacără roșiatică. Ars în oxigen sau în substanțe care degajă oxigen se volatilizează în parte și colorează flacăra în verde:
4B + 3O2 = 2B2O3;  H = -175 kcal/mol
H = -175 kcal/mol
Borul reacționează la cald cu clorul (la 400°C), dând triclorura de bor, BCl3, sau cu bromul (la 700°C), dând tribromura de bor, BBr3 etc.; la temperaturi peste 900°C se combină cu azotul formând nitrura de bor, BN; cu carbonul formează carbura de bor, iar cu unele metale formează boruri.
Borul este indiferent față de acizi în condiții obișnuite; acidul azotic concentrat și apa regală la cald îl oxidează lent la acid boric:
B + 3HNO3 = H3BO3 + 3NO2
Cu alcalii reacționează prin topire, dând borați:
2B + 6NaOH = 2Na3BO3 + 3H2
Din cauza afinității lui pentru oxigen și pentru alte elemente electronegative, borul poate reduce metalele din oxizi, sulfuri și cloruri.
Utilizare. Borul se folosește la fabricarea oțelurilor speciale (de obicei sub forma unui aliaj de fier cu 10-20% B, numit
ferobor), apoi la fabricarea diferitelor aliaje cu Cu, Cr, Si, W etc., întrebuințate în tehnică pentru calitățile lor remarcabile de rezistență mecanică și chimică. Borul se mai folosește încă și la întărirea grăsimilor, având rol de catalizator la hidrogenare.
În combinațiile sale, borul este în general tricovalent. Halogenurile au însă și caracter ionic; ele manifestă tendința să hidrolizeze. Aceasta se explică prin sarcina mare a nucleului de bor raportată la un volum atomic mic. Sarcina relativ mare a nucleului de bor explică și afinitatea acestui element pentru oxigen.
Din cauza proprietății lui de a forma covalențe, borul poate lega concomitent elemente electropozitive și electronegative, de exemplu hidrogen și oxigen. Din aceeași cauză poate forma lanțuri în care atomii de bor sunt uniți între ei (ca și atomii de carbon).
Compușii borului manifestă tendința de a forma combinații complexe, ca de exemplu acidul fluoroboric, H[BF4], și sărurile sale, fluoroborații.
Cele mai importante combinații ale borului sunt hidrurile, halogenurile, dar mai ales anhidrida borică și acidul boric.
Boranii. Chimia combinațiilor borului cu hidrogenului, adică
chimia boranilor, este relativ recentă.
Boranii se pot clasifica în două grupe, cu formulele generale BnHn+4 și BnHn+6. Toți boranii din prima grupă sunt relativ stabili din punct de vedere termic, pe când cei din grupa a doua sunt nestabili.
Niciun boran izolat nu corespunde formulei simple saturate, BH3; cel mai simplu boran este diboranul, B2H6, care în multe proprietăți fizice se aseamănă cu etanul, C2H6. Se deosebește însă de acesta prin configurația electronică.
Măsurători în infraroșu și de difracție electronică au sugerat pentru diboran o structură în care cei doi atomi de bor cu cei patru atomi de hidrogen terminali se găsesc în același plan, iar cei doi atomi de hidrogen care leagă atomii de bor ca punți se găsesc dispuși simetric deasupra și dedesubtul acestui plan.
Structura diboranului
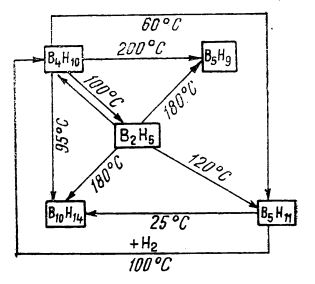
Dacă se încălzește magneziu metalic cu un exces de trioxid de bor, se obține borura de magneziu, prin a cărei tratare cu un acid (fosforic sau clorhidric) rezultă un gaz format din hidrogen ce conține diferiți borani, mai ales tetraboran, B4H10. Separarea acestora se face prin răcire cu aer lichid, urmată de distilare fracționată. Însă, această metodă este astăzi folosită numai pentru obținerea hexaboranului, B6H10.
Diboranul, B2H6, se obține cu randamente cantitative prin reacția dintre o hidrură metalică și trifluorura de bor, BF3, ca de exemplu din tetrahidroborat de sodiu:
3NaBH4 + 4BF3 = 3NaBF4 + 2B2H6
Diboranul se mai poate prepara prin reacția între triclorura de bor, BCl3, și hidrogen, peste un catalizator de Cu-Al, la 450°C.
Boranii superiori se obțin prin reacții de “cracare” încălzind diboranul cu hidrogen în condiții specifice (figura de mai jos).
Conversia reciprocă a boranilor
Toți boranii sunt substanțe volatile, cu miros respingător, caracteristic; cei mai mulți se aprind în contact cu aerul. Boranii sunt hidrolizați de apă, dar mai ales de hidroxizi alcalini, când rezultă un borat și hidrogen.
Boranii sunt folosiți pentru prepararea combustibililor pentru rachete de mare distanță.
Derivații boranilor. De la borani derivă un număr din ce în ce mai mare de compuși. Dacă se ține seamă și de derivații organici ai borului, chimia boranilor tinde să se apropie de varietatea și complexitatea chimiei compușilor carbonului.
Hidroborații sunt combinații ale boranilor cu metalele; ei sunt de tipul M
I[BH
4]
n, unde metalul poate fi un metal alcalin, sau Be, Mg, Al, Ti, Th, etc. Dintre hidroborații alcalini, care sunt substanțe nevolatile și stabile, cel mai obișnuit este tetrahidroboratul de sodiu, NaBH
4, folosit ca agent reducător, sau pentru prepararea boranilor. Hidroborații sunt în general combinații ionice.
Borazina, B
3N
3H
6, are oarecare asemănări cu benzenul, cu care este izoelectronic și izostructural:
Borazină Benzen
Însă, în timp ce la benzen, legăturile
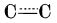
sunt nepolare și nucleul benzenic este rezistent la reacțiile de adiție, nucleul de borazină este foarte reactiv; poate adiționa cu ușurință trei molecule de H
2O sau HCl. Se descompune cu ușurință în timp.
Toți halogenii formează cu borul compuși de tipul BX3. De asemenea se cunoaște o clorură de bor, cu compoziția B2Cl4. Dintre halogenurile de bor, cea mai importantă este trifluorura, BF3, un gaz incolor care se poate prepara prin încălzirea trioxidului de bor, B2O3, cu tetrafluoroborat de amoniu, NH4BF3:
2B2O3 + NH4BF4 = BF3 + NH4B4O6F
Trifluorura de bor este unul dintre cei mai energici acceptori de electroni (acid Lewis) cunoscuți; formează combinații de adiție cu alcooli, eteri, amine, etc. Datorită acestei proprietăți este folosit la promovarea diferitelor reacții organice, comportându-se ca un catalizator.
La trecerea unor cantități mici de BF3 în apă se obține o soluție de acid fluoroboric:
4BF3 + 6H2O = 3H3O+ + 3BF4- + B(OH)3
Acidul fluoroboric nu a fost izolat în stare pură; sărurile sale au fost însă izolate ca, de exemplu, cele de NH4+, de metale alcaline și alcalino-pământoase.
După fluor, borul manifestă cea mai mare afinitate pentru oxigen. Compușii de bor cu oxigenul conțin unitatea structurală BO3 plană, cu unghiuri de 120°, sau unitatea structurală BO4, tetraedrică.
Trioxidul de bor sau
anhidrida borică, B
2O
3, se obține prin arderea borului în curent de oxigen sau prin deshidratarea acidului boric. Este o masă sticloasă, incoloră, care se topește la circa 600°C. Anhidrida borică nu este redusă de cărbune. Este solubilă în apă cu mare degajare de căldură din cauza formării acidului boric:
B2O3 + 3H2O = 2H3BO3
În stare topită, trioxidul de bor dizolvă majoritatea oxizilor metalici dând sticle de borat.
Acidul boric, mai exact
acidul ortoboric, H
3BO
3, se găsește în natură în ținuturile vulcanice (Toscana), în gazele amestecate cu vapori de apă care ies din pământ (“fumarole”), precum și în unele izvoare termale. În cantități foarte mici se găsește în fructe.
Acidul boric se prepară prin acțiunea acidului clorhidric sau acidului sulfuric asupra tetraboratului de sodiu (Na2B4O7, borax):
Na2B4O7 + 2HCl + 5H2O = 2NaCl + 4H3BO3
Acidul boric se prezintă sub formă de cristale albe strălucitoare, aciculare, în care unitățile B(OH)3 sunt unite între ele prin punți de hidrogen formând straturi cu simetrie aproape hexagonală. Distanța dintre straturile cristalului este de 3,18 Å, ceea ce explică clivajul pronunțat al acidului boric. Încălzit la flacără se volatilizează colorând flacăra în verde. Solubilitatea lui în apă crește cu temperatura. La fierberea unei soluții de acid boric cu apă se volatilizează și acidul boric (așa se explică existența lui în amestec cu vaporii de apă care se degajă o dată cu gazele vulcanice).
Acidul boric este un acid tribazic foarte slab (K1 = 7,3·10-10). Prin încălzire, acidul boric pierde treptat apa trecând în final în trioxid de bor, B2O3:
Acidul boric reacționează cu oxizii metalici formând săruri. El are proprietatea de a pune în libertate acizii volatili din sărurile lor. Astfel, dacă se tratează clorură de sodiu cu acid boric se degajă acid clorhidric:
H3BO3 + NaCl = HCl + NaBO2 + H2O
Cu acidul silicic, respectiv silicați, formează silicați complecși (borosilicați); cu alcooli formează esteri. (esterul metilic al acidului boric imprimă flăcării de alcool o culoare verde caracteristică.)
Cea mai mare parte a acidului boric este întrebuințată pentru prepararea emailurilor și a glazurilor, la prepararea boraxului și a altor borați, la prepararea diferitelor culori minerale, ca agent de impregnare ignifug pentru țesături, pentru conservarea unor alimente (carne, pește, ouă), pentru prepararea unor produse antiseptice și în cosmetică.
Sărurile acidului boric -
borații - se găsesc și în natură ca minerale, de obicei în formă hidratată. În stare anhidră se prepară prin topirea anhidridei borice cu oxizi metalici, când se poate obține o gamă întreagă de borați cristalizați.
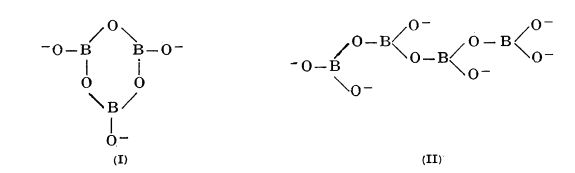
Compoziția boraților nu corespunde numai acidului ortoboric, ci și unei varietăți de forme condensate, care pot conține chiar mai mult de cinci atomi de bor într-un anion borat. Acești anioni sunt polimeri ciclici sau liniari formați prin unirea unor unități de BO3 sau BO4 prin intermediul unor atomi de oxigen comuni. Un exemplu de borat cu anion ciclic (I) este K3B3O6 și un exemplu de borat cu anioni în formă de lanț (II) este CaB2O4:
Borații hidratați care se obțin prin cristalizare din soluții apoase conțin de asemenea polianioni în cristal.
Borații alcalini sunt ușor solubili în apă, soluțiile apoase având reacție bazică din cauza hidrolizei. Ceilalți borați sunt greu solubili. Dintre borați, mai important din punct de vedere tehnic este boraxul.
Tetraboratul de sodiu sau boraxul, Na
2B
4O
7·10H
2O, adică sarea de sodiu a acidului tetraboric (care nu se cunoaște în stare liberă), se găsește în natură sub forma mineralelor
tincal, Na
2B
4O
7·10H
2O (în Tibet), sau
kernit, Na
2B
4O
7·4H
2O. Boraxul se prepară prin tratarea acidului boric cu o soluție caldă de hidroxid de sodiu:
4H3BO3 + 2NaOH = Na2B4O7 + 7H2O
Se prezintă sub formă de cristale monoclinice, incolore, puțin solubile în apă la temperatura obișnuită; soluția apoasă are caracter puternic bazic. Boraxul cristalizează în mod curent cu 10 molecule de apă, pe care le pierde prin încălzire la circa 400°C. Se topește la 878°C trecând într-o masă sticloasă. În stare topită dizolvă oxizi metalici și formează săruri duble ale acidului metaboric. Deoarece acestea au deseori culori caracteristice, formarea lor este aplicată în chimia analitică, pentru recunoașterea metalelor. Probele se fac cu perle de borax. Culoarea perlelor variază nu numai după natura metalului, ci și după cum flacăra este oxidantă sau reducătoare.
Boraxul se folosește în industria sticlei și ceramicii la prepararea glazurilor, sticlelor colorate, strasului, sticlei de Yena, sticlelor optice, etc., în metalurgie pentru sudură și lipire (dizolvând oxizii metalici, este un foarte bun decapant), în industria săpunurilor nealcaline, ca adaos la cleiuri (ca să nu mucegăiască), în industria textilă ca mordant și pentru spălarea pânzeturilor, în cosmetică, în medicină etc.
Peroxoborații sunt combinații de adiție a apei oxigenate la borați, adică borați-peroxihidrați (de exemplu NaBO
2·H
2O
2). Deoarece în soluție apoasă se descompun cu punerea în libertate a apei oxigenate, sunt folosiți ca agenți de înălbire și dezinfectanți.
Cel mai important borat-peroxihidrat este perboraxul, Na2B4O7·H2O2·9H2O, care se obține prin dizolvare în apă a unui amestec de acid boric și peroxid de sodiu:
4H3BO3 + Na2O2 = Na2B4O7·H2O2 + 5H2O
Din apă cristalizează borat-peroxihidratul NaBO2·H2O2·3H2O, care este o sare albă, cristalină, folosită în prafurile de spălare și albire, pentru conținutul său de “oxigen activ”, pe care îl pune în libertate.
 H = -175 kcal/mol
H = -175 kcal/mol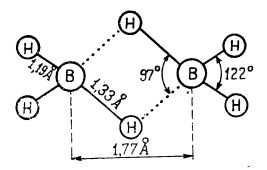
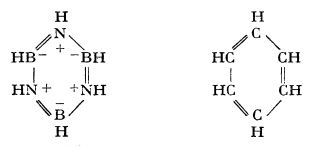
 sunt nepolare și nucleul benzenic este rezistent la reacțiile de adiție, nucleul de borazină este foarte reactiv; poate adiționa cu ușurință trei molecule de H2O sau HCl. Se descompune cu ușurință în timp.
sunt nepolare și nucleul benzenic este rezistent la reacțiile de adiție, nucleul de borazină este foarte reactiv; poate adiționa cu ușurință trei molecule de H2O sau HCl. Se descompune cu ușurință în timp.