Entalpia
Tag-uri
Partajeaza in Google Classroom
Teorie: Teorie - Entalpia Descarcă PDF
Energia internă, U, reprezintă energia totală a unui sistem termodinamic, adică suma tuturor energiilor cinetice şi potenţiale ale particulelor care fac parte din sistemul respectiv.
Funcţia de stare este o funcţie independentă de calea prin care se ajunge de la o stare iniţială la o stare finală. Funcţiile de stare sunt dependente de proprietăţile care determină starea curentă a unui sistem (variabilele de stare): presiunea, volumul, temperatura.
Mărimile de stare extensive sunt mărimile care depind de cantitatea de substanţă din sistem. De exemplu, masa şi volumul sunt mărimi de stare extensive.
Energia internă este o mărime de stare extensivă.
Mărimile de stare intensive sunt mărimile care nu depind de cantitatea de substanţă din sistem. De exemplu, temperatura, densitatea, şi presiunea sunt mărimi de stare intensive.
Variaţia energiei interne a unui sistem, ΔU, este egală cu diferenţa dintre energia internă finală şi energia internă iniţială a sistemului:
Uf – Ui = ΔU
Lucrul mecanic este transferul de energie care duce la mişcarea obiectelor, în timp ce căldura este transferul de energie ce duce la mişcarea particulelor care compun obiectele.
Funcţiile de proces sunt funcţiile dependente de calea prin care un sistem termodinamic ajunge de la o stare iniţială la o stare finală.
Căldura şi lucrul mecanic sunt funcţii de proces, adică sunt dependente de tipul de transfer: lucrul mecanic este un transfer de energie prin acţiuni mecanice, în timp ce căldura este un transfer de energie prin interacţiuni termice.
Entalpia, H, este o măsură a căldurii absorbite sau degajate în reacţiile chimice. Entalpia este o funcţie de stare a unui astfel de sistem termodinamic.
Entalpia este definită prin următoarea relaţie:
H = U + pV
U – energia internă a sistemului
p – presiunea sistemului
V – volumul sistemului
pV – acest produs reprezintă lucrul mecanic necesar pentru ca sistemul să-şi poată ocupa volumul propriu V la presiunea constantă p.
Variaţia entalpiei, ΔH, este o proprietate termodinamică a sistemului care este egală cu energia pusă la dispoziţie sub formă de căldură într-o reacţie chimică, la presiune constantă. Cu alte cuvinte, căldura degajată într-o reacţie exotermă, sau căldura absorbită într-o reacţie endotermă, la presiune constantă, reprezintă variaţia entalpiei.
Fiind o funcţie de stare, variaţia entalpiei depinde numai de o anumită stare iniţială şi o stare finală a sistemului. Astfel, se poate obţine ecuaţia matematică a variaţiei de entalpie dintr-un sistem:
ΔH = H2 – H1 = (U2 + pV2) – (U1 + pV1)
ΔH = ΔU + pΔV
Ținând cont de următoarele simplificări:
- presiunea sistemului nu variază;
- singurul lucru mecanic efectuat în sistem este lucrul mecanic al presiunii la variaţia volumului (lucrul mecanic necesar pentru ca sistemul să ocupe volumul propriu în mediul exterior);
variaţia entalpiei poate fi definită în felul următor:
Variaţia entalpiei unui sistem chimic este egală cu cantitatea de căldură transferată într-o reacţie ce are loc la presiune constantă, Qp:
ΔH = Qp
În cazul în care o reacţie se desfăşoară la volum constant, căldura de reacţie, QV, este egală cu variaţia energiei interne a sistemului chimic:
QV = ΔU
Pentru o reacţie chimică care se desfăşoară conform acestei reacţii generale:
reactanţi 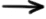 produşi de reacţie, variaţia entalpiei poate fi definită prin următoarea relaţie:
produşi de reacţie, variaţia entalpiei poate fi definită prin următoarea relaţie:
ΔH = Hfinal – Hiniţial = Hproduşi - Hreactanţi
Entalpia este o mărime de stare extensivă, aşadar depinde de numărul de moli de substanţă:
Htotal = ν · Hmol
Pentru o reacţie chimică de forma generală:
ν1R1 + ν2R2 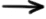 ν1P1 + ν2P2, variaţia entalpiei va fi:
ν1P1 + ν2P2, variaţia entalpiei va fi:
ΔH = Hproduşi - Hreactanţi = (ν1HP1 + ν2HP2) – (ν1HR1 + ν2HR2)
Calorimetria este o ramură a termodinamicii care se ocupă cu măsurarea căldurii degajate sau absorbite în diferite fenomene fizico-chimice. Calorimetrul este aparatul folosit pentru astfel de măsurători.






