Manganul, Mn, este un metal de tranziție argintiu din grupa 7 a tabelului periodic (grupa a VII-a secundară sau grupa VII B); are numărul atomic 25 și masa atomică 54,94. Punctul de topire al manganului este la 1244°C, iar punctul de fierbere este la 1962°C. Manganul are un caracter ușor electropozitiv, combinându-se cu unele nemetale printre care oxigenul și azotul.
Manganul este mult răspândit în natură (0,085%); dintre metalele grele, numai fierul este mai abundent. El se găsește mai ales în roci silicioase, unde însoțește fierul. Dintre mineralele de mangan, cele mai importante sunt: piroluzita, MnO2; psilomelanul, MnO2·nH2O; braunitul, Mn2O3; manganitul, MnO(OH); hausmanitul, Mn3O4; rodocrozitul, MnCO3; rodonitul, MnSiO3.
Aceste minerale sunt răspândite în Rusia, Spania, Brazilia, Africa, India, Japonia etc. În România se găsesc zăcăminte bogate în Carpații Orientali, în Banat, în munții Sebeșului, etc.
Urme de mangan există în plante și animale, unde are rol de catalizator pentru reacțiile care se desfășoară în celulele organismelor.
Manganul nu se poate obține prin reducerea oxizilor cu cărbune, deoarece, în acest caz, metalul ar avea un conținut apreciabil de carbon care se îndepărtează greu. Foarte des se prepară însă aliaje de fier și mangan în care prezența carbonului nu dăunează. Prepararea manganului pur se face prin aluminotermie folosind, fie piroluzita, MnO2, care prin încălzire trece întâi în Mn3O4 fie, direct, hausmanitul, Mn3O4:
3Mn3O4 + 8Al = 9Mn + 4Al2O3
Manganul este un metal cu aspect argintiu, asemănător fierului, însă foarte dur. Cantități mici de siliciu îi măresc într-atât duritatea, încât zgârie și oțelul. La aer se acoperă cu un strat fin de oxid, cu aspect de irizații. Oxidarea nu înaintează la încălzire; dacă manganul este însă în stare de pulbere fină, el devine pirofor. În această stare, el descompune apa la temperatura obișnuită și este ușor atacat de acizii diluați, cu degajare de hidrogen:
Mn + 2H+ = Mn2+ + H2
Acidul sulfuric concentrat îl atacă cu dezvoltare de SO2, iar acidul azotic, cu dezvoltare de NO. Cu clorul formează clorura manganoasă, MnCl2. Se mai combină cu sulful, cu azotul, carbonul, siliciul, borul, dar nu cu hidrogenul. Nu se combină direct cu oxidul de carbon, dar pe cale indirectă s-a reușit să se obțină carbonilul de mangan, Mn2(CO)10.
Din punct de vedere industrial sunt importante aliajele de fier și mangan: fonta oglindă (spiegel), care conține 6-22% Mn, și feromanganul, care conține 25-80% Mn. Feromanganul folosește la fabricarea oțelurilor speciale, dure, cum sunt acelea pentru unele. Aliajele de Fe-Mn-Si, numite silicomanganuri, conțin 50-70% Mn, 15-25% Si, 1-2% C, restul Fe; ele servesc mai ales ca dezoxidanți la prelucrarea fontelor în convertizorul Bessemer (manganul reduce oxizii de fier și oxidul de mangan rezultat formează cu silicea un silicat de mangan fuzibil). Tot în acest scop silicomanganul se adaugă și altor aliaje, ca de exemplu la bronzuri. Aliajele de cupru și mangan sunt rezistente la acțiunea corozivă a apei de mare, din care cauză se folosesc la fabricarea elicelor de vapoare. Aliajele de mangan și aluminiu fiind ușoare și rezistente, sunt utilizate în industria automobilelor și avioanelor. Unele aliaje de mangan sunt folosite ca rezistențe electrice (de exemplu manganina, un aliaj Cu-Mn-Ni).
Manganul formează un număr mare de combinații, în care manifestă numerele de oxidare de la +2 la +7 (tabelul de mai jos), corespunzător numărului de electroni 3d și 4s. Starea de oxidare +7 se manifestă numai în câțiva compuși (Mn2O7, MnO)4-. Trecerea manganului de la starea de oxidare Mn(VII) la starea de oxidare Mn(II) imprimă caracter oxidant compușilor de Mn(VII). Cea mai stabilă stare de oxidare este Mn(II) având nivelurile d semiocupate.
Combinațiile manganului
Număr de
oxidare |
Oxizi
Formulă |
Oxizi
Caracter |
Hidroxizi
Formulă |
Ioni în soluție
Formulă |
Ioni în soluție
Culoare |
| +2 |
MnO |
bazic |
Mn(OH)2 |
Mn2+ |
roz |
| +3 |
Mn2O3 |
bazic |
MnO(OH) |
Mn3+ |
violet |
| +4 |
MnO2 |
amfoter |
Mn(OH)4 |
Mn4+
[MnO4]4- |
brun |
| +5 |
- |
- |
- |
[MnO4]3- |
albastru |
| +6 |
MnO3 |
- |
H2MnO4 |
[MnO4]2- |
verde |
| +7 |
Mn2O7 |
acid |
HMnO4 |
[MnO4]- |
violet |
Există și câteva combinații complexe în care manganul manifestă numere de oxidare și mai mici, de exemplu +1 în M5I[Mn(CN)6], zero în Mn2(CO)10, -1 în Mn(CO)5-, etc.
De la aproape toate numerele de oxidare ale manganului se cunosc oxizi. Odată cu creșterea numărului de oxidare scade caracterul lor bazic și se accentuează cel acid. Astfel, MnO și Mn2O3 sunt oxizi bazici, MnO2 este amfoter; existența trioxidului de mangan, MnO3, în stare liberă nu a fost confirmată încă, dar combinațiile derivate de la acesta, manganații, M2I[MnO4], sunt săruri, manganul fiind în radicalul acid; Mn2O7 este o anhidridă acidă, și anume anhidrida acidului permanganic, HMnO4, care este un acid tare.
Se mai cunoaște și un oxid mixt, Mn3O4, 2MnO·MnO2.
Oxidul de mangan(II) sau
oxidul manganos, MnO, se obține prin reducerea oxizilor superiori sau prin calcinarea carbonatului manganos în curentul de hidrogen. Este o pulbere verde, insolubilă în apă, folosită în industria porțelanului, sticlelor colorate, etc.
Hidroxidul de mangan(II) sau
hidroxidul manganos, Mn(OH)
2, rezultă, când se tratează soluția unei sări manganoase cu un hidroxid alcalin, sub formă de precipitat alb, care la aer devine brun, din cauza formării unor oxizi intermediari, până la MnO
2:
Mn(OH)2 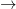 Mn2O3·xH2O
Mn2O3·xH2O 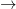 MnO2·xH2O
MnO2·xH2O
Trioxidul de mangan(II), adică
oxidul manganic sau
sescvioxidul de mangan, Mn
2O
3, se găsește în natură ca mineralul
braunit. Se obține prin încălzirea lentă a dioxidului de mangan, MnO
2, în aer, la 500-900°C, sau prin calcinarea sărurilor manganoase în curent de aer sau oxigen:
2MnO2 + O2 = Mn2O3 + 3/2 O2
Încălzit puternic (la circa 1000°C) în aer sau oxigen, trece în Mn3O4, mai exact MnIIMn2IIIO4, care este o substanță cu structură spinelică.
Tratat cu un acid, oxidul manganic trece fie în sarea respectivă a manganului(III), fie într-o sare manganoasă și dioxid de mangan, adică are loc un proces de oxido-reducere.
Oxidul de mangan (III) hidratat, Mn
2O
3·H
2O, sau
metahidroxidul manganic, MnO(OH), apare în natură ca mineralul
manganit; el poate fi și preparat. Folosește drept pigment brun și în imprimeria textilă.
Heptoxidul de mangan, Mn
2O
7, rezultă prin tratarea permanganatului de potasiu cu acid sulfuric la temperatură joasă:
2KMnO4 + H2SO4 = K2SO4 + Mn2O7 + H2O
Este un lichid uleios, de culoare închisă, care se dizolvă în apă rece. Soluția are culoarea violetă din cauza prezenței ionilor de permanganat, [MnO4]:
Mn2O7 + H2O = 2[MnO4]- + 2H+
Cel mai important oxid al manganului este dioxidul de mangan, MnO
2. (Vezi
Dioxidul de mangan)
Manganul(II) formează o serie de săruri cu anionii obișnuiți. Multe dintre ele sunt solubile în apă; ionul hidratat [Mn(H2O)6]2+ este de culoare roz. În soluții alcaline au tendință pronunțată să treacă în dioxid de mangan hidratat. Prin faptul că acționează accelerant asupra unor procese de oxidare cu oxigenul din aer, sărurile manganoase, în special cele organice, sunt folosite ca sicativi (de exemplu rezinatul sau linoleatul de mangan).
Dintre sărurile de mangan(II) mai importante sunt: clorura, sulfatul și carbonatul.
Clorura de mangan(II) sau
clorura manganoasă, MnCl
2, se obține tratând oxidul sau carbonatul de mangan cu acid clorhidric. Este o substanță cristalină solubilă în apă; din soluție cristalizează ca tetrahidrat. În stare anhidră formează cristale roz, higroscopice.
MnO2 + H2SO4 = MnSO4 + H2O + ½ O2
În stare anhidră este o substanță albă solubilă în apă; din soluție cristalizează în cristale roz, cu conținut variabil de apă (de la monohidrat la heptahidrat). Ca și MnCl2 folosește la obținerea altor combinații ale manganului, apoi drept pigment în industria textilă și ceramică, etc.
Carbonatul de mangan(II) sau
carbonatul manganos, MnCO
3, răspândit în natură ca mineralul rodocrozit, este folosit la prepararea feromanganului, deoarece se descompune la 100°C:
MnCO3 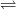 MnO + CO2
MnO + CO2
Calcinat la aer trece în Mn3O4.
De la manganul(III) derivă diferite săruri; ele se obțin de obicei prin oxidarea sărurilor manganoase. Sunt substanțe de culoare violetă sau verde; în soluție sunt roșii sau brune. Sunt foarte nestabile. În soluție acidă, la o slabă încălzire, sunt reduse la săruri de mangan(II); au tendință să formeze complecși.
Dintre sărurile de mangan(III), mai important este sulfatul de mangan(III), care rezultă prin acțiunea acidului sulfuric asupra oxidului manganic; din soluție cristalizează sub formă de cristale roșii de Mn2(SO4)3·H2SO4·4H2O. Prin încălzire rezultă sulfatul manganic verde. Cu sulfați alcalini formează sulfați dubli, M2ISO4·Mn2[SO4]3.
Acetatul de mangan(III), Mn(C
2H
3O
2)
3·2H
2O este unul dintre cei mai cunoscuți compuși ai manganului(III). Fiind relativ ușor de preparat și stabil folosește la prepararea altor compuși ai manganului(III).
Trioxidul de mangan, MnO
3, ca și acidul manganic, H
2MnO
4, nu au fost identificați încă. Se cunosc însă o serie de manganați, M
2I[MnO
4], care ar deriva din aceștia. Astfel, prin încălzirea dioxidului de mangan cu azotat de potasiu se obține o topitură verde, care conține manganați (vezi
Manganații).
Acidul permanganic, HMnO
4, nu se cunoaște decât în soluție cu concentrație până la 20%; în soluții mai concentrate se descompune. Este un acid tare, cu putere oxidantă. Sărurile sale se numesc permanganați. (Vezi
Permanganații).
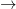 Mn2O3·xH2O
Mn2O3·xH2O 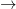 MnO2·xH2O
MnO2·xH2O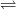 MnO + CO2
MnO + CO2





