Grupa a IV-a secundară (grupa 4 sau grupa IV B) a tabelului periodic cuprinde elementele rare titan, Ti, zirconiu, Zr și hafniu, Hf.
Ca și elementele din grupa a III-a secundară, metalele din grupa 4 sunt
elemente de tranziție; atomii elementelor din grupa 4 au stratul electronic exterior și cel penultim incomplet:
Având patru electroni de valență, elementele titan, zirconiu și toriu au numărul de oxidare maxim patru; în acest caz, atomii elementelor dobândesc configurația electronică a gazelor rare premergătoare lor în tabel: argon, kripton și radon. Deși hafniul are stratul electronic exterior analog titanului și zirconiului, se deosebește de celelalte elemente din grupă prin faptul că urmează imediat lantanidelor, adică are cu (4+14) = 18 electroni mai mulți decât gazul rar premergător lui, xenonul.
Elementele din grupa a IV-a secundară pot manifesta uneori și numere de oxidare doi sau trei.
Electronii (n-1)d2 se găsesc la un nivel de energie foarte apropiat electronilor ns2; energia de ionizare fiind de același ordin de mărime, uneori pot fi cedați succesiv cei doi electroni din stratul exterior și apoi unul sau doi electroni din stratul penultim.
Proprietățile fizice ale elementelor din grupa a IV-a secundară sunt ilustrate în tabelul de mai jos:
Caracteristicile elementelor din grupa a IV-a secundară a tabelului periodic
| Caracteristici |
Titan
Ti |
Zirconiu
Zr |
Hafniu
Hf |
| Numărul atomic |
22 |
40 |
72 |
| Configurația electronică exterioară |
3d24s2 |
4d25s2 |
5d26s2 |
| Masa atomică |
47,90 |
91,22 |
178,49 |
| Densitatea (s), g/cm3 |
4,51 |
6,49 |
13,1 |
| Punctul de topire, °C |
1660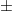 10 10 |
1852 |
2227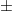 20 20 |
| Punctul de fierbere, °C |
3287 |
4377 |
4602 |
| Potențialul de ionizare, eV |
6,83 |
6,95 |
5,5 |
| Electronegativitatea (Pauling) |
1,5 |
1,4 |
1,3 |
| Raza de covalență, Å |
1,36 |
1,48 |
- |
| Raza ionică (pt. X4+), Å |
0,6 |
0,8 |
0,86 |
Proprietățile elementelor din grupa a IV-a secundară arată că:
-
la numere inferioare de oxidare predomină caracterul metalic, pe când la numerele superioare, cel nemetalic (de exemplu, de la titan se cunosc combinații în care el apare sub formă de cationi Ti2+ și Ti3+, precum și dioxidul de titan, TiO2 în care titanul se manifestă ca nemetal, ca și carbonul sau siliciul);
-
stabilitatea combinațiilor în care elementele au numere inferioare de oxidare se micșorează odată cu creșterea masei atomice a elementului (de exemplu compușii de Ti(II) și Ti(III) sunt bine cunoscuți; la zirconiu și hafniu existența unor astfel de compuși a fost mult timp nesigură întrucât au caracter reducător foarte pronunțat);
-
pe măsură ce crește numărul atomic al elementului, se accentuează caracterul lui metalic.
În comportarea lor față de hidrogen, elementele grupei a IV-a secundare se deosebesc de cele ale grupei a IV-a principale prin faptul că pot absorbi cantități mari de hidrogen (dependente de temperatura și presiunea de lucru).
La temperatura obișnuită, metalele grupei a IV-a secundare nu sunt reactive; la temperaturi mai înalte formează combinații cu halogenii, sulful, azotul, carbonul.
Titanul și zirconiul, datorită slabei lor bazicități, nu formează săruri obișnuite cu oxoacizi. De la zirconiu se cunoaște un sulfat, Zr(SO4)2, însă acesta nu poate fi cristalizat din apă deoarece trece în săruri bazice. Tot așa, azotatul de zirconiu, Zr(NO3)4, trece cu ușurință în azotat bazic.







