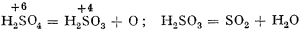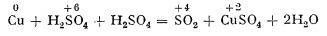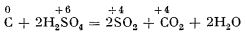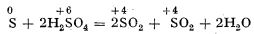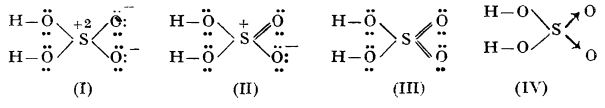Acidul sulfuric, H2SO4, este un lichid incolor, uleios, cu punctul de topire la 10,36°C și punctul de fierbere la 338°C. Acidul sulfuric pur este folosit foarte rar; în general este disponibil sub formă de soluție de concentrație 96-98%, cu punctul de topire la 3°C. Numele întreg al acidului sulfuric este acid tetraoxosulfuric (IV).
În industrie există mai multe procedee pentru obținerea acidului sulfuric; oricare ar fi însă procedeul utilizat, întâi trebuie obținut dioxidul de sulf (prin prăjirea sulfurilor metalice, mai rar prin arderea sulfului sau prin descompunerea ghipsului).
Gazele sulfuroase rezultate din cuptorul de prăjire (un amestec de circa 7-10% SO2, 10% O2, 83% N2), după ce sunt trecute prin camerele de desprăfuire (mecanice și electrice), pentru a fi purificate de praful de cenușă antrenat din cuptor, se transformă în acid sulfuric prin oxidarea dioxidului de sulf și adiționarea apei).
Oxidarea dioxidului de sulf se poate face prin două metode: prin contact și cu nitroză.
Gazele provenite de la prăjirea piritei în amestec cu aer, după ce în prealabil au fost desprăfuite, sunt purificate prin spălături repetate în turnuri, în contracurent cu soluții de acid sulfuric, și uscate cu acid sulfuric concentrat; în acest mod, substanțele străine antrenate, mai ales compușii de arsen, sunt eliminate pentru a nu împiedica acțiunea catalizatorului prin otrăvire. După aceea, gazele sunt încălzite într-un schimbător de căldură și apoi trecute peste catalizator (oxid de vanadiu sau oxid de fier, mai rar azbest platinat) în prezența căruia are loc oxidarea dioxidului de sulf la trioxid de sulf de către oxigenul din aer (figura de mai jos).
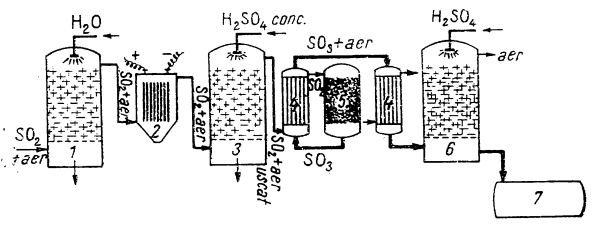 Schema de fabricare a acidului sulfuric de contact:
1
Schema de fabricare a acidului sulfuric de contact:
1 - turn de spălare;
2 - filtru electric;
3 - turn de uscare;
4 - schimbătoare de căldură;
5 - sobă de cataliză;
6 - turn de absorbție;
7 - rezervor de H
2SO
4 concentrat.
În timpul catalizei, din cauza căldurii dezvoltate, temperatura se menține între 430 și 450°C. Trioxidul de sulf format este trecut apoi prin schimbătorul de căldură, unde cedează căldura (gazelor de prăjire care urmează să intre în soba de cataliză). De acolo trece în turnuri de absorbție, pentru a fi absorbit în acid sulfuric concentrat.
În modul acesta se poate obține acid sulfuric foarte concentrat (98% H2SO4), precum și oleum (acid sulfuric anhidru, în care s-a introdus o cantitate de trioxid de sulf).
În acest procedeu, reacția între dioxid de sulf și oxigen are loc la suprafața catalizatorului; de aceea, el poartă numele de “procedeul prin contact”.
Procedeul prin contact este mai simplu din punctul de vedere al reacțiilor chimice și produce un acid sulfuric mai pur și mai concentrat (98% H2SO4) decât cel fabricat prin procedeul cu oxizi de azot (78% H2SO4).
SO2 + NO2 → H2SO4 + NO
SO2 + N2O3 + H2O → H2SO4 + 2NI
Prin urmare, în timpul oxidării dioxidului de sulf, oxizii de azot sunt reduși la monoxid de azot, care, în contact cu oxigenul din aer, trece din nou în oxizi superiori. Aceasta înseamnă că o cantitate mică de oxizi de azot ar putea transforma cantități nelimitate de dioxid de sulf în acid sulfuric.
În industrie, oxidarea dioxidului de sulf cu ajutorul oxizilor de azot se face în
camere de plumb sau în
turnuri. Oricare ar fi instalația, gazele despărfuite intră, cu o temperatură de 300-400°C, într-un
turn de denitrare (
turnul Glover), căptușit cu plăci de plumb și umplut cu materiale poros și rezistent la acțiunea acizilor (de exemplu gresie, pietre de lavă). Prin partea superioară a turnului curge, sub formă pulverizată, o soluție de oxizi de azot în acid sulfuric, numită “
nitroză”, care se formează în ultima parte a instalației, în
turnul de absorbție (
turnul Gay-Lussac). Comportamentul principal al nitrozei este sulfatul acid de nitrozil (numit și acidul nitrozil-sulfuric), NOHSO
4, care rezultă din acid sulfuric, prin înlocuirea unui atom de hidrogen cu o grupă nitrozo
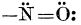
.
Procesul chimic care are loc ar putea fi explicat în felul următor:
În turnul Glover, datorită suprafeței mari a materialului din interior, contactul între nitroză și gazele sulfuroase se face foarte bine. Temperatura gazelor fiind ridicată și în prezența vaporilor de apă, acidul nitrozil-sulfuric este supus hidrolizei; rezultă acid sulfuric și oxizi de azot:
2NOHSO4 + H2O  2H2SO4 + NO + NO2
2H2SO4 + NO + NO2
care reacționează cu apa, formând acid azotos:
NO + NO2 + H2O → 2HNO2
Tot în turn, dioxidul de sulf din gazele de prăjire reacționează cu apa, formând acidul sulfuros:
SO2 + H2O → H2SO3
Acesta reacționează cu acidul azotos și formează acid sulfuric, monoxid de azot și apă:
H2SO3 + 2HNO2 → H2SO4 + 2NO + H2O
În același timp, din cauza temperaturii înalte se evaporă o parte din apa conținută în acid, astfel încât în rezervorul de plumb, care se găsește la baza turnului, se adună acid sulfuric mai concentrat (75-78%), numit acid de turn.
Restul de gaze (70-80%, format din dioxid de sulf, aer și oxizi de azot) se ridică în partea de sus a turnului, și răcit sub 100°C de nitroza care intră, trece în camerele de plumb (încăperi de formă paralelipipedică, de obicei trei la număr, goale în interior, cu pereții și fundul din plăci de plumb), unde are loc oxidarea monoxidului de azot la dioxid de azot:
2NO + O2 → 2NO2
Acesta, în prezența apei reci introduse în camere sub formă de ploaie fină, oxidează dioxidul de sulf la acid sulfuric:
SO2 + NO2 + H2O → H2SO4 + NO
Acidul sulfuric format, numit acid de cameră, are o concentrație de 60-70%. El se adună în partea inferioră a camerelor.
Gazele care părăsesc camerele de plumb, practic, nu mai conțin dioxid de sulf, ci numai oxizi de azot. Ele pătrund prin partea inferioară a turnului Gay-Lussac (construit de asemenea din plăci de plumb și umplute cu material poros). Prin partea superioară curge, sub formă de picături fine, acid sulfuric concentrat, adus din turnul Glover. Acidul absoarbe oxizii de azot, formând sulfat acid de nitrozil:
Sulfatul acid de nitrozil este apoi trimis în turnul Glover, unde stropește gazele ce vine de la prăjirea piritei.
Gazele din turnul de absorbție Gay-Lussac, formate din resturi de oxizi de azot și oxigen care nu au intrat în reacție, sunt eliminate în atmosferă. Pentru a compensa pierderile în oxizi de azot, în turnul de denitrare se introduce o cantitate mică de acid azotic.
Instalația cu camere de plumb prezintă însă unele dezavantaje: concentrația mică a acidului sulfuric obținut (65%), cantități mari de plumb ca material de instalații (de unde prețul ridicat al instalației), aparatura ocupă spații mari și capacitatea de producție este scăzută. Din această cauză se preferă instalații cu turnuri.
În turnuri, reacția de oxidare a dioxidului de sulf se face cu mult mai repede decât în camerele de de plumb și prin aceasta productivitatea și concentrația acidului este mărită.
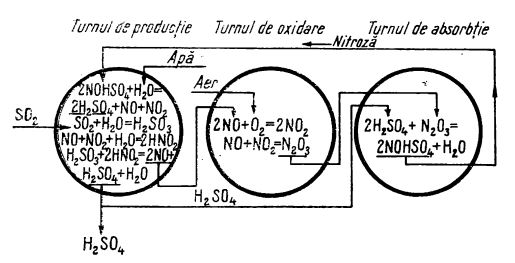
Instalația se compune din cinci turnuri (figura de mai jos), două de producție, similare turnurilor Glover, unul de oxidare, în locul camerelor de plumb, și două de absorbție, similare turnurilor Gay-Lussac. Turnul de oxidare este gol în interior.
Schema reacțiilor la fabricarea acidului sulfuric prin procedeul cu nitroză, în turnuri
Gazele de prăjire cu conținut de SO2 intră în turnurile de producție, unde oxizii de azot oxidează dioxidul de sulf. Cum la ieșirea din turnurile de producție (după oxidarea dioxidului de sulf) gazele conțin mai mult NO decât NO2, ele sunt trecute în turnul de oxidare, unde sunt oxidate până la un grad aproape de N2O3, și apoi în turnurile de absorbție, unde are loc absorbția lor în acid sulfuric, adică formarea nitrozei. Aceasta este trimisă apoi în turnurile de producție.
Acidul sulfuric obținut în camerele de plumb are concentrația 65%, iar cel obținut în turnuri este de 75%; pentru a avea o concentrație mai mare, acidul sulfuric astfel obținut trebuie supus evaporării.
Cea mai mare concentrație la care se poate ajunge prin încălzirea acidului sulfuric este 98%; în practică se obține concentrarea până la 96%.
Acidul sulfuric este un lichid incolor, fără miros și vâscos când este concentrat. În stare pură cristalizează la 10,36°C.
Se cunosc diferiți hidrați ai acidului sulfuric, de exemplu H2SO4 ⸱ H2O, care cristalizează la 8,5°C; H2SO4 ⸱ 2H2O, care cristalizează la -38°C; H2SO4 ⸱ 4H2O, care cristalizează la -27°C.
Acidul de 98,2% are densitatea 1,84 și fierbe la 338°C. Dacă acidul este mai diluat, prin încălzire distilă întâi apa până când concentrația acidului ajunge la 98,2%; tot așa, când concentrația acidului este mai mare decât 98,2%, prin fierbere se degajă întâi SO3, până când acidul ajunge din nou la concentrația de 98,2%. Amestecul de 98,2% acid sulfuric cu apă, în timpul fierberii, respectiv distilării, nu își mai schimbă compoziția; el este deci un amestec azeotrop.
Acidul sulfuric se dizolvă în apă în orice proporție și cu degajare de foarte multă căldură (

H = -20,42 kcal/mol) datorită hidratării ionilor HSO
4- și H
3O
+.
Dacă se toarnă brusc acid sulfuric în apă, acesta fiind mai greu decât apa, se adună în fundul vasului, încălzind apa din stratul imediat superior. Temperatura apei astfel încălzită se poate ridica chiar la 100°C; vaporii de apă produși pot răbufni prin toată masa de lichid, antrenând și împroșcând în afară picături de acid sulfuric. Din cauza energiei reacției între acidul sulfuric și apă,
nu trebuie turnat niciodată apă în acid sulfuric; pentru prepararea unor soluții de acid sulfuric, se introduce acidul sulfuric câte puțin în apă, amestecând continuu.
Acidul sulfuric este foarte avid de apă. Astfel, dacă o cantitate cântărită de acid sulfuric este ținută un timp descoperită într-un pahar, masa lui crește datorită absorbției vaporilor de apă din atmosferă. Pe această proprietate se bazează întrebuințarea acidului sulfuric ca deshidratant (de exemplu în exsicatoare, în laborator); de asemenea, și în multe reacții chimice se folosește acid sulfuric pentru îndepărtarea apei formate în reacție.
Caracteristică este acțiunea acidului sulfuric asupra substanțelor organice. Dacă se toarnă puțin acid sulfuric peste zahăr, hârtie sau lemn, aceste substanțe întâi se îngălbenesc și pe urmă se înnegresc. Acidul sulfuric scoate hidrogenul și oxigenul din substanțele organice pentru a forma apă, și în modul acesta carbonul rămâne liber, colorând restul substanțelor în negru:
Deoarece substanțele organice sunt distruse prin acțiunea acidului sulfuric, este necesară multă atenție la manipularea lui.
Acidul sulfuric este un acid bibazic tare, în soluție apoasă diluată, prima disociație fiind practic completă:
H2SO4 → H+ + HSO4-
HSO4-  H+ + SO42-; K2 = 1,29 ⸱ 10-2
H+ + SO42-; K2 = 1,29 ⸱ 10-2
Acidul sulfuric diluat reacționează numai cu metalele situate în seria tensiunilor electromagnetice la stânga hidrogenului; rezultă sulfatul metalului respectiv și hidrogen. De exemplu, reacția acidului sulfuric cu zinc:
Zn + H2SO4 → ZnSO4 + H2
Ca orice acid tare, acidul sulfuric reacționează și cu oxizi bazici, cu baze sau cu săruri, formând sulfați:
CuO + H2SO4 → CuSO4 + H2O
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
BaCl2 + H2SO4 → BaSO4 + 2HCl
Astfel, dacă în acid sulfuric diluat (sau o soluție de sulfat) se pun câteva picături de soluție de clorură de bariu, se formează un precipitat alb de sulfat de bariu, BaSO4. Reacția fiind caracteristică atât ionului SO42- cât și ionului Ba2+, folosește ca reacție de identificare și determinare a acestor ioni.
Având punctul de fierbere ridicat, acidul sulfuric poate înlocui un acid mai volatil din sărurile sale. Astfel, prin încălzirea azotatului de sodiu cu acid sulfuric, rezultă acid azotic:
NaNO3 + H2SO4 → NaHSO4 + HNO3
Importanță practică prezintă comportarea acidului sulfuric față de fier și plumb. Fierul este foarte ușor atacat de acidul sulfuric diluat, dar rezistă acțiunii acidului concentrat. Acest fenomen se numește pasivitate. Pasivitatea se datorează sulfatului de fier format din oxidul de fier rezultat intermediar prin acțiunea oxidantă a acidului sulfuric concentrat. Sulfatul de fier se depune sub formă de strat subțire pe suprafața metalului, astfel încât împiedică acidul sulfuric concentrat să atace mai departe fierul. Sulfatul de fier este solubilizat de acidul sulfuric diluat; deci, în acest mediu, stratul protector se dizolvă și astfel fierul este mereu expus acțiunii acidului. Din această cauză , nuami acidul sulfuric concentrat (peste 93% H2SO4) poate fi păstrat în vase de fontă.
Plumbul este atacat numai superficial de acidul sulfuric diluat, stratul de sulfat de plumb fiind protector; în schimb este atacat de acidul sulfuric concentrat (peste 80% H2SO4), în care sulfatul de plumb este solubil.
Caracterul oxidant al acidului sulfuric
Acidul sulfuric poate ceda oxigen, comportându-se deci ca un
oxidant. În aceste reacții, sulful, de la numărul de oxidare +6, trece la numărul de oxidare +4:
Astfel, în reacția dintre acidul sulfuric și cupru, oxigenul eliberat oxidează metalul la oxid, care reacționează cu o altă cantitate de acid sulfuric:
Cu + O → CuO
CuO + H2SO4 → CuSO4 + H2O
Prin urmare, cuprul, cedând doi electroni, se oxidează, pe când sulful, primind doi electroni, se reduce:
De aceea, dacă într-o eprubetă care conține acid sulfuric concentrat se introduce o cantitate mică de cupru (sârmă sau strunjitură), la încălzire se degajă dioxid de sulf, care se recunoaște după miros. Dacă, după răcire, se toarnă în eprubetă puțină apă, soluția are culoarea albastră din cauza sulfatului de cupru format.
În mod similar, carbonul este oxidat de acidul sulfuric concentrat, la cald:
Astfel, dacă într-o eprubetă prevăzută cu tub de culegere se introduce o bucată mică de cărbune de lemn și apoi se toarnă acid sulfuric concentrat, la încălzire până la fierbere are loc o degajare concomitentă dioxid de sulf și dioxid de carbon. Dioxidul de sulf se identifică introducând capătul tubului de culegere într-o eprubetă cu soluție diluată de iod în iodură de potasiu; soluția se decolorează. Pentru identificarea dioxidului de carbon, capătul tubului de culegere se cufundă într-o eprubetă cu apă de var; aceasta se tulbură.
Tot așa, acidul sulfuric concentrat la cald poate oxida sulful la dioxid de sulf:
Astfel, dacă într-o eprubetă care conține o cantitate mică de sulf, se toarnă câțiva milimetri de acid sulfuric concentrat și se încălzește până la fierbere, sulful se topește sub stratul de acid și reacționează cu acidul sulfuric; se degajă dioxid de sulf, care se identifică după miros, sau, mai bine, prin decolorarea unei soluții de iod în iodură de potasiu.
Cu unii compuși organici, acidul sulfuric formează acizi sulfonici. Notând compusul organic cu R — H, în care R reprezentând un radical organic, iar acidul sulfonic cu R — H, în care R reprezintă un radical organic, iar acidul sulfonic cu R — SO3H, reacția de sulfonare se poate reprezenta în forma generală:
R — H + H2SO4 → R — SO3H +H2O
Sulfonarea este o reacție importantă în chimia organică.
Acidul sulfuric este unul din cele mai importante produse din întreaga industrie chimică; aproape că nu există nicio ramură a economiei naționale, unde, într-o măsură mai mare sau mai mică, direct sau indirect, să nu se utilizeze acidul sulfuric. Astfel, acidul sulfuric este întrebuințat la fabricarea multor acizi precum: acidul clorhidric, acidul azotic, acidul carbonic,acidul fosforic, la fabricarea unor explozivi, a celuloidului și a unor coloranți (în amestec cu acid azotic), la fabricarea uleiurilor tehnice pentru industria textilă și tăbăcărie, la fabricarea unor insecticide, la rafinarea unor produse petroliere (benzine, petrol lampant, uleiuri etc.), la decaparea metalelor.
Trebuie menționat rolul important al acidului sulfuric la fabricarea îngrășămintelor agricole, mai ales a sulfatului de amoniu și a superfosfaților. Pentru prepararea superfosfaților se consumă aproape jumătate din producția mondială de acid sulfuric.
Acidul sulfuric se folosește și la fabricarea sărurilor sale - sulfații.
Sulfații (sărurile acidului sulfuric) sunt de două tipuri: sulfați acizi, MIHSO4, și sulfați neutri, M2ISO4.
Sulfații acizi ai metalelor alcaline (sulfații de hidrogen și metal alcalin), cunoscuți și sub denumirea veche de bisulfați, sunt ușor solubili în apă. Prin încălzire peste punctul de topire pierd apă și trec în pirosulfați, M2IS2O7:
2NaHSO4 → H2O + NaS2O7
Pirosulfații, la încălzire mai puternică, se descompun în sulfați și trioxid de sulf:
Na2S2O7 → Na2SO4 + SO3
Sulfații neutri sunt stabili la temperatură mai înaltă. Cei mai mulți sunt solubili în apă. Excepție fac sulfații de plumb, bariu, stronțiu și calciu. Sulfații solubili în apă cristalizează din soluție sub formă de hidrați cristalini (de exemplu, FeSO4 ⸱ 7H2O, CuSO4 ⸱ 5H2O etc.). Mulți dintre sulfați formează săruri duble; de exemplu AlK(SO4)2 ⸱ 12H2O - alaunul.
Zn + H2SO4 → ZnSO4 + H2
CuO + H2SO4 → CuSO4 + H2O
Na2CO3 + H2SO4 → NaSO4 + CO2 + H2O
Na2SO4 + BaCl2 → BaSO4 + 2NaCl
2Na2SO3 + O2 → 2Na2SO4
Unii sulfați se găsesc în pământ sub formă de minerale, de exemplu: sulfatul de calciu, CaSO4 (ghipsul), sulfatul de bariu, BaSO4 (baritina) etc.
Cercetări efectuate cu raze X au arătat că ionul SO42- este o grupă structurală bine definită, în care legăturile covalente dintre cei patru atomi de oxigen și atomul central de sulf sunt echivalente între ele. Cei patru atomi de oxigen se găsesc în vârfurile unui tetraedru regulat, lungimea legăturii S — O fiind de 1,51 Å.
Pentru molecula de H2SO4 sunt posibile structurile (I), (II) și (III):
Molecula reală a acidului sulfuric are structura intermediară între structurile limită (I), (II) și (III). Se obișnuiește să se folosească pentru acidul sulfuric și formula (IV), care indică o structură echivalentă cu structura (I).
Se observă că la structura (I) legăturile sunt formate prin participarea orbitalilor 3s și 3p, pe când la structurile (II) și (III), la formarea legăturilor participă și orbitalii 3d.

 .
.  2H2SO4 + NO + NO2
2H2SO4 + NO + NO2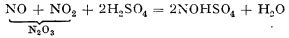
 H+ + SO42-; K2 = 1,29 ⸱ 10-2
H+ + SO42-; K2 = 1,29 ⸱ 10-2