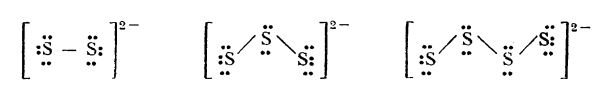Hidrogenul sulfurat (sau sulfura de hidrogen), H2S, este un gaz inflamabil, toxic și fără culoare, cu miros de ouă stricate, care fierbe la -60°C. Hidrogenul sulfurat este solubil în apă și alcool și este folosit drept reactiv analitic, ca sursă de sulf, și la purificarea acizilor clorhidric și sulfuric.
Hidrogenul sulfurat (monosulfanul sau sulfanul) se găsește liber în natură, dar în cantități mici, ca rezultat al putrezirii substanțelor animale. Astfel, mirosul ouălor clocite se datorează prezenței hidrogenului sulfurat provenit din sulful existent în substanțele albuminoide.
În cantități ceva mai mari, hidrogenul sulfurat apare la erupțiile vulcanice. Unele ape minerale, așa-numitele izvoare sulfuroase, conțin dizolvat hidrogen sulfurat.
De asemenea, s-a descoperit prezența hidrogenului sulfurat în fundul Mării Negre și în unele părți ale Mării Baltice; el provine din proteine descompuse în absența aerului, sub influența unor microorganisme (nu poate ajunge la suprafață, deoarece este descompus prin acțiunea altor microorganisme sulfuroase care trăiesc la o anumită adâncime de la suprafață).
Hidrogenul sulfurat este un acid slab, de aceea poate fi obținut dintr-o sare a lui - o sulfură - și un acid mai puternic și neoxidant. Reacția de bază este:
S2- + 2H+  H2S
H2S
De preferință se folosesc sulfurile metalelor grele - de exemplu sulfura de fier - și acidul clorhidric (sau acidul sulfuric):
FeS + 2HCl → FeCl2 + H2S
Hidrogenul sulfurat este un gaz incolor, cu miros caracteristic de ouă stricate. Este mai greu decât aerul (are densitatea 1,19). Se lichefiază la -60,75°C și se solidifică la -85,6°C.
Cercetări spectrale și valoarea momentului electric arată că, în molecula de hidrogen sulfurat, unghiul între valențele sulfului este de 90°:
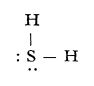 Molecula de hidrogen sulfurat
Molecula de hidrogen sulfurat
Distanța S — H este de 1,34 Å, iar momentul electric μ = 0,93 D.
Prin încălzire, hidrogenul sulfurat se descompune în componente:
H2S  H2 + S;
H2 + S;  H = 4,8 kcal/mol
H = 4,8 kcal/mol
La 310°C descompunerea este slabă: ea însă crește odată cu ridicarea temperaturii.
Hidrogenul sulfurat arde în aer, formând apă (vapori) și dioxid de sulf:
2H2S + 3O2 → 2H2O + 2SO2
Când oxigenul este în cantitate insuficientă, în loc de dioxid de sulf se separă sulf:
2H2S + O2 → 2H2O + 2S
Astfel, dacă se aprinde hidrogenul sulfurat la capătul unui tub efilat (care străbate dopul ce închide o eprubetă în care se prepară hidrogen sulfurat, sau este legat de tubul de culegere al unui generator de gaze) și peste flacără se așează, cu gura în jos, un pahar de sticlă, rece și uscat, acesta se aburește din cauza apei formate; dacă în flacără se ține fundul unei capsule de porțelan, rece, pe porțelan apare o pată galbenă de sulf rezultată prin arderea incompletă a hidrogenului sulfurat.
Hidrogenul sulfurat reacționează cu cele mai multe metale, formând sulfuri. Astfel, o piesă de argint, ținută într-o atmosferă cu hidrogen sulfurat, se acoperă cu un strat de sulfură de argint, de culoare neagră:
H2S + 2Ag → Ag2S + H2
Reacția este folosită pentru identificarea urmelor de hidrogen sulfurat.
Hidrogenul sulfurat reacționează și cu unele nemetale, de exemplu cu clorul sau cu bromul; se formează acidul halogenat respectiv, iar sulful este pus în libertate:
H2S + Cl2 → 2HCl + S
De aceea, la intoxicarea cu hidrogen sulfurat se inhalează apă de clor proaspăt preparată.
2H2S + SO2 → 2H2O + 3S
Hidrogenul sulfurat este solubil în apă; la 20°C, un volum de apă dizolvă 2,6 vol. H2S. Soluția saturată obținută se numește apă de hidrogen sulfurat, sau, datorită proprietăților ei de acid, acid sulfhidric; este însă un acid foarte slab.
Ca orice acid dibazic, acidul sulfhidric disociază în două trepte:
H2S  H+ + HS- K1 = 0,87 ⸱ 10-7
H+ + HS- K1 = 0,87 ⸱ 10-7
HS-  H+ + S2- K2 = 0,79 ⸱ 10-13
H+ + S2- K2 = 0,79 ⸱ 10-13
El poate fi neutralizat de baze formând sulfuri. Reacția are loc în două etape: la început are loc formarea unei sulfuri acide, care apoi, cu o altă cantitate de hidroxid, trece în sulfură neutră:
H2S + NaOH → NaHS + H2O
NaHS + NaOH → Na2S + H2O
Acidul sulfhidric poate forma sulfuri și cu oxizi bazici sau cu săruri:
H2S + PbO → PbS + H2O
H2S + CuSO4 → CuS + H2SO4
Prin acțiunea oxigenului din aer asupra acidului sulfhidric, sulful este pus în libertate; din această cauză, apa de hidrogen sulfurat nu este stabilă (cu timpul se tulbură din cauza sulfului separat).
Hidrogenul sulfurat este foarte toxic; inhalat în cantități mici produce dureri de cap și amețeli, iar în cantități mai mari, chiar moartea.
Hidrogenul sulfurat este foarte folosit în laborator drept reactiv, întrucât formează sulfuri colorate caracteristic, care precipită din soluții.
Sulfurile (sărurile acidului sulfhidric) sunt de două tipuri: sulfuri acide, M
IHS, și sulfuri neutre, M
2IS (M
I = metal monovalent).
Sulfurile acide sunt toate solubile în apă; dintre cele neutre sunt solubile sulfurile alcaline. Acestea sunt hidrolizate în soluție apoasă; soluția are reacție alcalină:
Na2S + H2O  NaOH + NaHS
NaOH + NaHS
Respectiv:
S2- + H2O  OH- + HS- K ≅ 1
OH- + HS- K ≅ 1
Majoritatea sulfurilor metalelor grele nu sunt solubile în apă; de aceea, ele se separă sub formă de precipitat în momentul formării lor. Foarte multe dintre aceste precipitate sunt colorate. Astfel, sulfura de fier, FeS, sulfura de cupru, CuS, sulfura de plumb, PbS, sunt de culoare neagră; sulfura de antimoniu, Sb2S3, este portocalie; sulfura de cadmiu, CdS, și sulfura de arsen, As2S3, sunt galbene; sulfura de mangan, MnS, este roz; sulfura de zinc, ZnS, și sulfura de bariu, BaS, sunt albe.
Sulfurile precipitate în soluție apoasă sau cele dizolvate se pot oxida la temperatura camerei, trecând în sulfați sau sulf elementar:
CuS + 2O2 → CuSO4
2Fe2S3 + 3O2 → 2Fe2O3 + 6S
De aceea, dacă pe o hârtie albă (sau de filtru) se scriu litere cu o soluție (incoloră) de acetat de plumb și hârtia se așază într-un curent de hidrogen sulfurat, semnele scrie se înnegresc datorită formării sulfurii de plumb, negre:
(CH3COO)2Pb + H2S → PbS + 2CH3COOH
Spălate apoi cu apă oxigenată, semnele devin albe, deoarece apa oxigenată oxidează sulfura de plumb, neagră, la sulfat de plumb, alb:
PbS + 4H2O2 → PbSO4 + 4H2O
Prin încălzire în curent de aer (sau de oxigen), sulfurile trec în oxizi (sau sulfați). Pe această proprietate se bazează obținerea dioxidului de sulf prin prăjirea altor sulfuri.
1. Sulfurile solubile (cele alcaline) se obțin prin tratarea hidroxizilor alcalini cu hidrogen sulfurat:
2NaOH + H2S → Na2S + 2H2O
2. Sulfurile insolubile se prepară prin tratarea soluției unei sări cu hidrogen sulfurat sau sulfură de amoniu:
CuSO4 + H2S → CuS + H2SO4
3. Reducerea sulfaților prin calcinare cu cărbune este o metodă mult aplicată în tehnică; așa se prepară, spre exemplu, sulfura de sodiu din sulfat de sodiu:
Na2SO4 + 4C → Na2S + 4CO
4. Prin sinteză direct din componente se obțin de asemenea unele sulfuri, de exemplu sulfura de fier:
Fe + S → FeS
Polisulfuri
Dacă o soluție de sulfură solubilă, de exemplu sulfura de sodiu, Na
2S, este fiartă cu sulf se obțin polisulfuri, compuși cu compoziția variind între Na
2S
2 și Na
2S
5. (Acești compuși se pot obține și prin topirea împreună a sulfului cu un carbonat alcalin).
Prin tratare cu acizi, polisulfurile sunt descompuse cu separare de sulf:
Na2S2 + 2HCl → 2NaCl + H2S + S
În anumite condiții nu se degajă hidrogen sulfurat, ci se obțin sulfanii respectivi. Aceștia, cu timpul, la aer, se descompun în hidrogen sulfurat și sulf.
În molecula unei polisulfuri, atomii de sulf sunt legați între ei; au numărul de oxidare -1. Li se atribuie următoarele structuri:
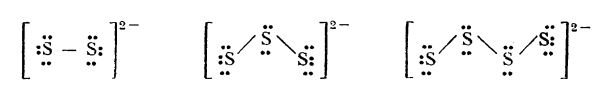 ion de disulfură ion de trisulfură ion de tetrasulfură
ion de disulfură ion de trisulfură ion de tetrasulfură
Sulfurile și polisulfurile sunt folosite împotriva paraziților plantelor, în industria pielăriei, în metalurgia minereurilor neferoase, la sinteza unor tipuri de cauciuc, etc.
 H2S
H2S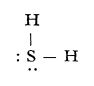
 H2 + S;
H2 + S;  H = 4,8 kcal/mol
H = 4,8 kcal/mol H+ + HS- K1 = 0,87 ⸱ 10-7
H+ + HS- K1 = 0,87 ⸱ 10-7 H+ + S2- K2 = 0,79 ⸱ 10-13
H+ + S2- K2 = 0,79 ⸱ 10-13 NaOH + NaHS
NaOH + NaHS OH- + HS- K ≅ 1
OH- + HS- K ≅ 1