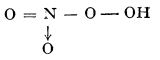Apa oxigenată (sau peroxidul de hidrogen), H
2O
2, este un lichid incolor, uneori albastru pal, vâscos și instabil care fierbe la 150,2°C și este solubil în apă și acool. Apa oxigenată este folosită ca decolorant, intermediar chimic, combustibil pentru rachete și antiseptic.
Apa oxigenată se poate prepara după mai multe metode:
a) Din peroxizi. Apa oxigenată se poate obține din peroxidul de bariu, BaO
2, sau de sodiu, Na
2O
3, prin tratare cu acid sulfuric sau acid fosforic:
BaO2 + H2SO4 → H2O2 + BaSO4
Apa oxigenată obținută este foarte diluată și impurificată cu urme de acid antrenat. De aceea, ea trebuie supusă unei distilări (care se face sub vid). Concomitent rezultă și sulfat de bariu, BaSO4.
b) Pe cale electrochimică. Din considerente economice, metoda obținerii apei oxigenate din peroxizi este folosită tot mai rar, peroxizii fiind greu de obținut. Astăzi, apa oxigenată se prepară pe cale electrochimică, din acid peroxodisulfuric (dipersulfuric).
În acest scop acidul sulfuric este supus electrolizei la temperaturi joase; prin oxidare anodică, el trece în acid peroxosulfuric (mai exact peroxodisulfuric), H2S2O8. Acesta, prin hidroliză, trece apoi în apă oxigenată și acid sulfuric (intermediar se formează acidul peroxomonosulfuric - monopersulfuric - H2SO5):
În loc de acid peroxodisulfuric se preferă folosirea peroxodisulfatului de amoniu, din care se obține în mod similar acidul peroxodisulfuric.
Soluția de apă oxigenată de 30% este cunoscută sub numele de perhidrol. Pentru scopuri industriale apa oxigenată se poate fabrica și mai concentrată (de 30-60%). S-a realizat și fabricarea unei ape oxigenate de 80-85% H2O2.
Molecula de apă oxigenată conține două grupe OH legate între ele prin atomii de oxigen. Aceste grupe se găsesc în două plane care formează între ele un unghi de 90°. Unghiul pe care îl formează legătura O — H cu legătură O — O este circa 110° (după cum este ilustrat în figura de mai jos).
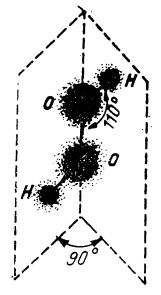 Molecula de apă oxigenată
Molecula de apă oxigenată
Legătura covalentă O — O este nepolară, pe când legăturile O — H sunt polare.
Apa oxigenată pură este un lichid incolor, siropos, cu densitatea 1,448, care fierbe la 150,2°C. Prin răcire la -0,5°C se solidifică sub formă de cristale. Cu apa este miscibilă în orice proporție. Soluția apoasă a apei oxigenate are reacție slab acidă.
Datorită caracterului polar al legăturilor O — H, sub influența moleculelor polare ale apei, apa oxigenată poate pune în libertate ioni de hidroniu:
H2O2 + H2O  H3O+ + HO2¯
H3O+ + HO2¯
Constanta de disociere este foarte mică (K = 1,5 · 10-12).
Având caracter acid, apa oxigenată poate forma săruri, care sunt peroxizii.
Molecula de apă oxigenată se descompune ușor și pune în libertate oxigen, reacția fiind însoțită de degajare de căldură:
2H2O2 → 2H2O + O2;  H = -23,47 kcal/mol
H = -23,47 kcal/mol
Procesul se produce foarte lent în soluție apoasă; este însă accelerat de lumină și de prezența unor substanțe cu acțiune catalitică, cum este platina, bioxidul de mangan, săruri alcaline, de fier, de cupru, praful de cărbune, pulberea de sticlă etc., precum și de unele enzime cu acțiune specifică (catalaze).
Pentru ca sărurile alcaline din compoziția sticlei să nu producă descompunerea lentă a apei oxigenate, aceasta se păstrează în sticle parafinate sau de polietilenă.
Există și substanțe care împiedică acțiunea de descompunere a apei oxigenate de către catalizatori sau enzime, ca de exemplu acidul fosforic (care înlătură acțiunea de descompunere a sărurilor de fier sau de mangan) și, mai ales acidul barbituric sau acidul uric.
De aceea se obișnuiește să se stabilizeze soluțiile de apă oxigenată, înainte de a fi date în consum, prin adăugare de substanțe cu asemenea acțiune.
Apa oxigenată poate acționa atât ca agent oxidant, cât și ca agent reducător.
Deoarece prin descompunerea ei, apa oxigenată pune în libertate oxigen, ea este un puternic oxidant; astfel, oxidează acidul sulfuros, H2SO3, la acid sulfuric, H2SO4; acidul azotos HNO2, la acid azotic, HNO3; sulfura de plumb, PbS, la sulfat de plumb, PbSO4:
H2SO3 + H2O2 → H2SO4 + H2O
HNO2 + H2O2 → HNO3 + H2O
PbS + 4H2O2 → PbSO4 + 4H2O
Reacția de oxidare a acidului iodhidric la iod servește la identificarea apei oxigenate:
2HI + H2O2 → I2 + 2H2O
Când apa oxigenată acționează drept oxidant, fiecare atom de oxigen trece de la numărul de oxidare -1 la numărul de oxidare -2. Reacția este:
H2O2 + 2e- → H2O + O2-
Apa oxigenată se poate descompune și în alt mod, și anume în hidrogen și oxigen:
H2O2 → H2 + O2;  H = 46,8 kcal/mol
H = 46,8 kcal/mol
Din cauza hidrogenului pus în libertate, apa oxigenată are proprietatea de a fi și reducătoare. Această acțiune o manifestă însă numai atunci când este în prezența unei substanțe mai puternic oxidată decât ea, cum este, de exemplu, permanganatul de potasiu:
2KMnO4 + 3H2SO4 + 5H2O2 → 2MnSO4 + K2SO4 + 8H2O + 5O2
Când apa oxigenată acționează drept reducător, fiecare atom de oxigen trece de la numărul de oxidare -1 la numărul de oxidare 0 (se degajă oxigen molecular). Reacția este:
H2O2 → O2 + 2H+ + 2e-
Apa oxigenată poate înlocui apa de cristalizare în multe săruri, de exemplu Na2CO3 · 3H2O2.
Apa oxigenată este folosită ca oxidant, decolorant și dezinfectant. Se folosește la înălbirea diferitelor materiale ca: paie, pene, păr, piei, blănuri și, mai ales, fibre textile. Decolorarea cu apă oxigenată înlocuiește din ce în ce mai mult decolorarea cu clor, deoarece, pe lângă acțiunea ei mai rapidă și cu eficacitate mai mare, atacă mai puțin fibra textilă.
Cantități mari de apă oxigenată se întrebuințează și pentru înălbirea grăsimilor și a uleiurilor. În acest scop se folosesc soluții cât se poate de concentrate (până la 60%).
În medicină, apa oxigenată este utilizată (de obicei în soluție de 3%) ca antiseptic, dezinfectant etc. Datorită acțiunii ei germicide este folosită în unele cazuri și pentru conservarea alimentelor (lapte, unt, bere etc.).
În pictură se folosește apa oxigenată pentru reîmprospătarea tablourilor vechi înnegrite. Astfel, culoarea albă a carbonatului de plumb, devenită neagră cu timpul din cauza sulfurii de plumb (care se formează prin acțiunea urmelor de hidrogen sulfurat din aer) este regenerată prin spălarea cu apă oxigenată.
Apa oxigenată mai este folosită și pentru prepararea altor decoloranți. De exemplu, împreună cu boraxul formează așa-numitul perborax, Na4B4O7 · H2O2 · 9H2O, necesar în industria textilă.
În amestec cu hidrat de hidrazină, metanol sau hidrocarburi, apa oxigenată poate folosi drept carburant pentru avioane cu reacție.
De la apa oxigenată derivă un număr mare de compuși (anorganici și organici). Compușii anorganici binari care conțin grupa peroxo, — O — O — , se numesc peroxizi. (Dacă numai un singur atom de hidrogen din molecula apei oxigenate este înlocuit cu un metal, rezultă un hidroperoxid, de exemplu hidroperoxidul de sodiu, NaOOH).
Peroxizii au caracter de săruri: prin tratare cu un acid diluat pun în libertate apa oxigenată. Dintre peroxizi, mai stabili sunt peroxizii metalelor alcaline și alcalino-pământoase. Peroxidul de sodiu, Na2O2, este utilizat ca sursă de H2O2 și pentru oxidări.
Peroxoacizii (denumiți uneori și peracizi) și sărurile lor conțin în moleculă grupa peroxo, — O — O —, în locul unui atom de oxigen, — O —; de exemplu, acidul peroxomonosulfuric, H2SO5, acidul peroxoazotic, HNO4:
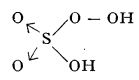
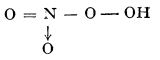
acid peroxomonosulfuric acid peroxoazotic
(acidul lui Caro)
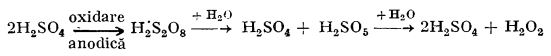

 H3O+ + HO2¯
H3O+ + HO2¯ H = -23,47 kcal/mol
H = -23,47 kcal/mol H = 46,8 kcal/mol
H = 46,8 kcal/mol