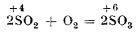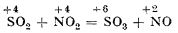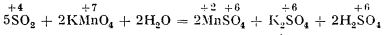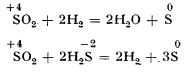Dioxidul de sulf, sau oxid de sulf (IV), SO
2, este un oxid al sulfului în care atomul de sulf are numărul de oxidare +4. Dioxidul de sulf gazos are un miros înțepător, iar în formă lichidă este incolor; se formează la arderea sulfului în aer. Dioxidul de sulf are punctul de topire la -72,7°C și punctul de fierbere la -10°C. La dizolvarea în apă a dioxidului de sulf se formează un amestec între acidul sulfuric, H
2SO
4, și acidul sulfuros, H
2SO
3.
Răspândire în natură
Dioxidul de sulf se găsește în natură în cantități reduse și variabile. Astfel, atmosfera orașelor industriale conține urme de dioxid de sulf rezultat prin combustia cărbunilor cu conținut de sulf. Dioxidul de sulf se mai găsește, de asemenea, în emanațiile vulcanice.
În laborator, dioxidul de sulf se obține prin tratarea sulfitului (acid sau neutru) de sodiu cu acid clorhidric (sau sulfuric). Se formează acidul sulfuros, H
2SO
3, care, fiind nestabil, se descompune; dioxidul de sulf rezultat se degajă:
NaHSO3 + HCl → NaCl + H2SO3
H2SO3 → SO2 + H2O
O altă metodă de preparare a dioxidului de sulf este reducerea acidului sulfuric concentrat, cu cupru, la temperatură înaltă:
2H2SO4 + Cu → CuSO4 + 2H2O + SO2
În loc de cupru, drept reducător se poate folosi cărbune sau sulf.
În industrie, dioxidul de sulf se prepară după diferite metode:
S + O2 → SO;  H = -70,9 kcal/mol
H = -70,9 kcal/mol
b) Prăjirea sulfurilor este o metodă generală pentru obținerea dioxidului de sulf. Căldura degajată din reacția:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2;  H = -102 kcal/mol SO2
H = -102 kcal/mol SO2
întreține prăjirea mai departe a piritei (de aceea se folosește combustibil numai pentru punerea în funcțiune a cuptorului).
Oxidul de fier rezultat în urma prăjirii piritei, cenușa de pirită, conține diferite impurități, de exemplu: cupru, zinc, argint și alte metale provenite din minereu. Recuperarea lor este o problemă economică de mare importanță.
În afară de pirite, pentru obținerea dioxidului de sulf se pot folosi și alte minereuri, de exemplu blenda; dioxidul de sulf rezultat prin prăjrea sulfurii de zinc reprezintă un produs secundar.
Prăjirea piritei sau a altor minereuri sulfurice se face pe grătare întinse sau în cuptoare cu etaje prevăzute cu agitare mecanică. Un procedeu modern este arderea piritei în “strat fluidizat”.
La acest procedeu, minereul foarte fin granulat, amestecat cu aer preîncălzit, întâlnește în cuptor un contracurent de aer care îl menține în suspensie în timpul arderii. În modul acesta se asigură o prăjire practic completă a minereului.
În România, acest procedeu de mare randament a fost introdus pentru prăjirea piritei la Uzina de superfosfați și acid sulfuric Năvodari, precum și pentru prăjirea blendei la Combinatele chimico-metalurgice de la Baia Mare și Copșa Mică.
c) Sulfatul de calciu (care se găsește în natură sub formă de ghips, CaSO
4 ⸱ 2H
2O, sau ca anhidrit, CaSO
4) poate fi folosit de asemenea pentru obținerea dioxidului de sulf. Deoarece se descompune însă abia la temperatura de 1350 - 1400°C:
2CaSO4 → 2CaO + 2SO2 + O2
se adaugă cărbune drept reducător:
2CaSO4 + 2C → 2CaO + 2SO2 + 2CO
Totodată se mai adaugă argilă și nisip. Concomitent cu gazele de prăjire, care conțin 7-7,5% SO2, se obține și un clincher de ciment asemănător cimentului obișnuit.
Dioxidul de sulf este un gaz incolor, cu miros înăbușitor; nu arde și nu întreține arderea. Are densitatea 2,93. Dioxidul de sulf se lichefiază ușor (la -10,1°C), trecând într-un lichid incolor (care se solidifică la -72,7°C).
Astfel, dacă se introduce capătul tubului de degajare de la un dispozitiv pentru prepararea dioxidului de sulf într-o eprubetă lungă și îngustă așezată într-un vas cu amestec răcitor, ca de exemplu gheață și sare (după cum e ilustrat în figura de mai jos), în eprubetă se adună dioxid de sulf lichid. Când se scoate eprubeta din amestecul răcitor, lichidul începe să fiarbă.
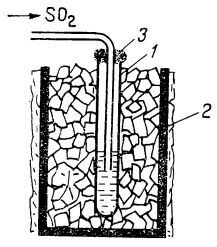 Lichefierea dioxidului de sulf:
1
Lichefierea dioxidului de sulf:
1 - eprubetă cu dioxid de sulf;
2 - vas cu amestec de
gheață și sare;
3 - dop de vată.
Dioxidul de sulf lichid dizolvă anumite hidrocarburi. Pe proprietatea lui de a fi perfect miscibil cu benzenul, dar numai parțial miscibil cu hidrocarburile parafinice (deci este un dizolvant selectiv), se bazează procedeul Edeleanu pentru rafinarea benzinei.
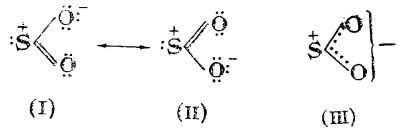
În molecula dioxidului de sulf cele două legături S — O sunt echivalente (au lungimea de 1,43 Å); ele formează un unghi O — S — O de 129°. Momentul electric al moleculei este μ = 1,61 D.
Ca urmare, s-a atribuit moleculei de dioxid de sulf o structură intermediară (de rezonanță) între structurile limită (I) și (II); această structură ar putea fi redată și prin formula (III) care reprezintă o suprapunere a celorlalte două structuri:
Dioxidul de sulf este solubil în apă (la 20°C se pot dizolva 10,5 g SO2 în 100 g apă). Soluția formată are caracter acid, deoarece conține acid sulfuros:
SO2 + H2O → H2SO3
Ca orice anhidridă acidă, dioxidul de sulf reacționează cu oxizi bazici sau cu baze, formând săruri, sulfiți:
SO2 + CaO → CaSO3
SO2 + 2NaOH → Na2SO3 + H2O
Caracterul reducător al dioxidului de sulf
Dioxidul de sulf are accentuate proprietăți reducătoare, sulful trecând de la numărul de oxidare +4 la numărul de oxidare +6. Astfel, el se combină direct cu oxigenul în prezența unui catalizator, trecând în trioxid de sulf:
De aceea, el poate reduce dioxidul de azot la oxid de azot:
sau permangantul de potasiu la sulfat manganos:
(Dacă se trece un curent de dioxid de sulf printr-o soluție violetă de permanganat de potasiu, soluția se decolorează.)
Mulți coloranți organici sunt decolorați de către dioxidul de sulf. (Astfel, dacă o hârtie de filtru îmbibată cu suc de fructe colorat se ține într-un curent de dioxid de sulf, hârtia se decolorează).
Acțiunea decolorantă a dioxidului de sulf se deosebește de aceea a clorului prin faptul că substanța colorantă este redusă de dioxid de sulf și nu oxidată de către oxigenul pus în libertate în apa de clor. Uneori, culoarea revine, deoarece compusul rezultat cu dioxid de sulf este instabil și se descompune . De exemplu, trandafirii roșii decolorați sub acțiunea dioxidului de sulf revin la culoarea lor inițială dacă sunt puși într-o soluție diluată de acid sulfuric, care îndepărtează dioxidul de sulf.
Caracterul oxidant al dioxidului de sulf
Uneori, dioxidul de sulf este și oxidant, sulful trecând de la numărul de oxidare +4 la numărul de oxidare zero sau -2. Astfel, poate fi redus de hidrogen sau de hidrogen sulfurat:
Dioxidul de sulf are o influență dăunătoare asupra vegetației, pe care o distruge, ceea ce se observă mai ales în jurul industriilor de acid sulfuric și cuptoarelor de prăjire a minereurilor de sulf. (Dioxidul de sulf reacționează cu picăturile de apă de pe frunzele plantelor, iar acidul sulfuros format reacționează cu fierul din clorofilă, distrugând-o, și astfel procesul de asimilație clorofiliană este împiedicat.)
În concentrație de 0,015%, dioxidul de sulf irită căile respiratorii, iar în concentrație de 0,05% poate provoca moartea.
Cea mai importantă întrebuințare a dioxidului de sulf este fabricarea acidului sulfuric (și, în parte, a acidului sulfuros). De asemenea, este mult întrebuințat pentru decolorarea fibrelor textile, penelor, țesăturilor de paie, pentru albirea pastei de hârtie, a cleiului, a gelatinei, la tratarea fructelor înainte de a fi conservate, la scoaterea petelor de fructe și de cerneală, etc.
Pentru acțiunea lui dezinfectantă este folosit la dezinfectarea încăperilor, a butoaielor de vin etc. În acest scop dioxidul de sulf este obținut direct prin arderea sulfului.
Lichefiat, dioxidul de sulf este întrebuințat ca dizolvant selectiv (la rafinarea benzinelor), precum și în aparate frigorifice (prin trecerea din stare lichidă în gaz produce o apreciabilă scădere de temperatură).
 H = -70,9 kcal/mol
H = -70,9 kcal/mol H = -102 kcal/mol SO2
H = -102 kcal/mol SO2