Hidroxidul de sodiu (soda caustică), NaOH, este un solid alb translucid și delicvescent, foarte solubil în apă și etanol, dar insolubil în eter. Punctul de topire al hidroxidului de sodiu este 318°C, iar punctul de topire este 1390°C. Este puternic alcalin și are multe aplicații în industria chimică, în special în producția de săpunuri și hârtie.
Hidroxidul de sodiu, NaOH, se poate obține direct din reacția dintre sodiu și apă. Industrial, se prepară prin diferite procedee dintre care cel mai răspândit este electroliza unei soluții de clorură de sodiu.
La anod se dezvoltă clor, iar la catod se dezvoltă hidrogen, concomitent cu formarea de hidroxid alcalin.Procesul se poate urmări folosind un vas cu soluție de clorură de sodiu în care se introduc capetele a două sârme legate la o sursă de curent electric continuu. Dacă în soluție se adaugă câteva picături de soluție de fenolftaleină (indicator), se observă cum împrejurul sârmei legate de polul negativ soluția se înroșește, dovedind prezența hidroxidului alcalin.
Este important ca hidroxidul de sodiu din jurul catodului să nu ajungă în contact cu clorul dezvoltat la anod, deoarece aceste substanțe pot reacționa între ele; în acest caz se formează hipoclorit de sodiu, NaClO:
Cl2 + 2NaOH = NaCl + NaClO + H2O
sau, la temperaturi mai înalte, clorat de sodiu, NaClO3:
3NaClO = NaClO3 + NaCl
și chiar perclorat de sodiu, NaClO4:
4NaClO3 = 3NaClO4 + NaCl
De aceea, trebuie să se realizeze o separare a produselor colectate la catod, de cele colectate la anod.
La procedeul cu diafragmă, celula electrolitică are în interior un perete poros - o diafragmă (de obicei o țesătură de azbest) - care desparte spațiul anodic de spațiul catodic, împiedicând amestecarea soluției de hidroxid de sodiu cu clor, dar cu o foarte mică rezistență pentru trecerea curentului electric. Diafragmele pot fi așezate orizontal sau vertical:
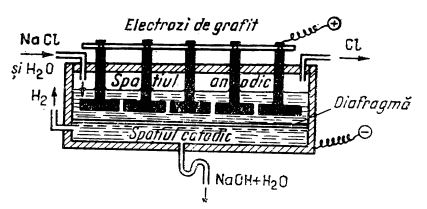 Celulă cu diafragmă orizontală pentru electroliza clorurii de sodiu
Celulă cu diafragmă orizontală pentru electroliza clorurii de sodiuVasul de oțel formează catodul. Prin capacul celulei străbat mai mulți electrozi de grafit; ei formează anodul. Clorul rezultat prin electroliză este aspirat prin conducta prevăzută în capacul celulei și deci nu poate trece în soluția de hidroxid de sodiu care se formează sub diafragmă.
Procedeul cu catod de mercur se deosebește de procedeul cu diafragmă prin faptul că drept catod se folosește mercur. În acest caz, ionii Na+ se descarcă pe mercur (deoarece, față de mercur, tensiunea de descărcare a ionilor Na+ este mai mică decât aceea a ionilor H+); concomitent se formează și clorul, care este aspirat. Sodiul separat formează cu mercurul amalgamul de sodiu (în celula electrolitică):
Na+ + e- + nHg = Na·nHg (amalgam)
care în contact cu apa, se descompune cu formare de hidroxid de sodiu, hidrogen și mercur (în dezamalgator sau pilă):
Na·nHg + H2O = NaOH + ½ H2 + nHg
Hidrogenul este aspirat, iar mercurul reintră în circuitul fabricației.
În figura de mai jos se arată schema tipului de celulă electrolitică utilizată și la noi în țară:
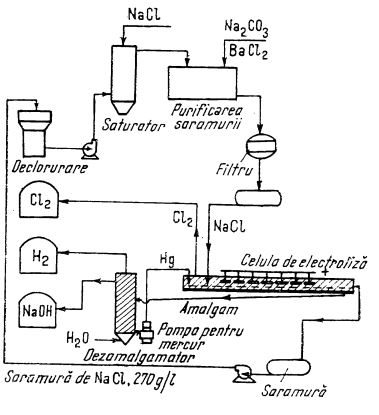 Schema electrolizei clorurii de sodiu cu catod de mercur
Schema electrolizei clorurii de sodiu cu catod de mercur
Hidroxidul de sodiu obținut prin acest procedeu este mult mai pur și nu mai conține clorură de sodiu (ca la procedeul cu diafragmă).
Hidroxidul de sodiu se mai obține prin tratarea unei soluții de carbonat de sodiu cu hidroxid de calciu:
Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3
Deoarece în acest proces soluția slab alcalină a carbonatului de sodiu devine puternic caustică din cauza formării hidroxidului de sodiu, reacția se numește caustificarea sodei. Reacția de caustificare este favorizată de temperatură înaltă și de agitare energică.
Hidroxidul de sodiu este o masă cristalină albă, translucidă și foarte higroscopică. Se topește la 318°C. Este foarte solubil în apă, solubilitatea crescând cu temperatura (la 20°C, în 100 g apă se dizolvă 109 g NaOH, iar 100°C, se dizolvă 342 g NaOH). Dizolvarea în apă este însoțită de dezvoltare de căldură din cauza formării unor hidrați (căldura de dizolvare este de circa 10 kcal/mol). Hidroxidul de sodiu este solubil și în alcool metilic sau alcool etilic.
Ținut la aer, hidroxidul de sodiu formează cu dioxidul de carbon din aer carbonat de sodiu, adică se carbonatează:
2NaOH + CO2 = Na2CO3 + H2O
Hidroxidul de sodiu atacă puternic pielea și carnea, de unde numele de sodă caustică. Soluțiile de hidroxid de sodiu sunt în special periculoase pentru ochi. El are toate proprietățile unei baze tari. În stare topită atacă sticla; chiar și platina este atacată în contact cu oxigenul din aer.
Hidroxidul de sodiu se utilizează în industria săpunurilor (la saponificarea grăsimilor) și a hârtiei, în industria țițeiului (pentru neutralizarea acidului sulfuric folosit la rafinarea produselor petroliere), în industria textilă (la mercerizarea bumbacului și la fabricarea fibrelor sintetice de vâscoză), în industria coloranților (la fabricarea alizarinei, a indigoului, etc.), apoi la fabricarea hipocloritului de sodiu, a fosfatului trisodic, în industria ceramică (pentru prepararea unor glazuri) etc.
Hidroxidul de sodiu este de asemenea folosit pentru a adsorbi gaze acide precum dioxidul de carbon și dioxidul de sulf, și este utilizat în tratarea apelor reziduale pentru eliminarea metalelor grele (sub formă de hidroxizi) și a acidității.








